РАСХОД УГЛЕРОДА ПРИ ЭЛЕКТРОЛИЗЕ АЛЮМИНИЯ КАТОДНЫЙ ВЫХОД ПО ТОКУ
Расход углерода при электролизе составляет в зависимости от типа электролизера и условий процесса от 500 до 600 кг на 1 т алюминия. При высокой стоимости анодной массы (147—157 руб/т) и особенно, обожженных анодов (245—261 руб/т) расходы на углерод составляют значительную долю в себестоимости алюминия. Поэтому вопрос о механизме потерь углерода является весьма важным для практики электролиза. Прежде всего необходимо знать, каков теоретический расход углерода. Это очевидно, зависит от состава первичного анодного газа. Если первичным газом является СO2, то как следует из реакции (15), расход углерода на 1 кг Аl будет составлять 0,333 кг. При первичном выделении СО эта величина будет в 2 раза больше — 0,666 кг/кг. Из-под корки электролита или газосборного колокола обычно выделяется смесь СO2 и СО с содержанием последнего от 40 до 60%. Однако это не значит, что состав первичного газа, т. е. газа, образующегося в первичных пузырьках на аноде, отвечает этому соотношению.
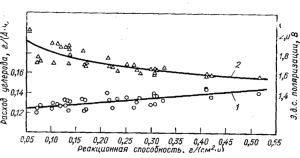
Рис. 24. Зависимость расхода углерода (1), э.д.с. поляризации (2) от реакционной способности угольного анода в условиях электролиза криолито-глиноземных расплавов (Ведерников)
Опыты, проведенные как на заводских электролизерах, так и в лабораторных ячейках, дают четкие доказательства того, что первичным газом является СO2. Например, если через графитовую трубу, служащую анодом в лабораторном электролизере, пропускать СO2, то без тока и при малых анодных плотностях тока газ будет содержать СО в соответствии с реакцией Будуара:
C + СO2 = 2СО (43)
Но по мере повышения силы тока газ на выходе из трубы будет обогащаться СO2и при плотности тока около 0,05 А/см2 СО исчезнет и остается чистая СО2(Тонстед). Этот результат можно легко понять, исходя из теории анодного перенапряжения. По мере повышения плотности тока на аноде происходит увеличение степени покрытия хемосорбированными оксидами СxО, парциальное давление кислорода над которыми выше, чем давление диссоциации СO2 и, тем более, чем СО. Если бы СО мог выделяться в качестве первичного газа, он немедленно бы окислялся до СO2 за счет взаимодействия с СхО.
Как уже упоминалось, газ на выходе из электролизера содержит значительные количества СО. Имеются две причины появления СО в анодных газах — взаимодействие первичного СO2 с растворенным в электролите алюминием (безотносительно, в какой форме находятся продукты его взаимодействия с электролитом — AlF или Na):
2Аl (р) + 3СO2= Аl2O3+ 3СО , (44)
и реакция окисления неполяризованного, т. е. не покрытого соединениями СxО углерода (реакция Будуара).
При температуре электролиза в равновесной газовой смеси по этой реакции содержание СО достигает 98%. Неполяризованным углеродом являются боковые грани анода, выступающие из электролита, и частицы осыпавшегося в электролит углерода — угольной пены, плавающей на поверхности электролита.
На состав анодного газа первая из этих реакций оказывает большее влияние, чем вторая. Если принять, что вторая реакция несущественна, то можно найти связь между составом газа и катодным выходом по току (Пирсон и Ваддингтон). Первичной реакцией будет Аl2O3+ 1,5С = 2Аl+1,5СO2.
Если выход по току ηт, то 1—ηТ— это потери алюминия по реакции 2(1—ηT)Al + 3(l—ηT)CO2=(l—ηт) · Аl2O3 + 3(1—ηт)СО.
В результате происходит изменение состава газа: СO2 будет 1,5—3(1—ηт) моля, СО 3(1—ηт) моля. Отсюда содержание СО2 в газе: NCО2= [1,5—3(1—ηт)]/1,5, и выход по току
ηT = 0,5 — 0,5NCO2 (45)
Однако расчеты по этой формуле дают заниженные величины выхода по току, поскольку фактически образование СО идет и по реакции Будуара.
Содержание СО в анодных газах, а значит, и количество углерода, расходуемое на разложение Аl2O3, изменяется в зависимости от параметров электролиза. Поэтому, как уже отмечалось, для суммарной реакции, протекающей в электролизере, приходится выражать количество атомов углерода, вступивших в реакцию, некоторой переменной величиной у:
Аl2O3 + yC = 2Al + (3 — у)СO2+(2у — 3)СО.
Отсюда получаем расход углерода в суммарной реакции, выраженный через состав анодных газов:
где тc — удельный расход углерода, кг на 1 кг алюминия.
В это уравнение вошли все виды расхода углерода внутри электролизера, т. е. под коркой электролита. Потери, связанные с горением потеков анодной массы выше корки, с испарением летучих с поверхности жидкой анодной массы в самообжигающихся анодах и механические потери здесь не учтены.
Из формулы (46) следует, что при Nсо2=1 получаем теоретический расход углерода 0,333 кг на 1 кг алюминия. Понижение содержания СO2 за счет реакции обратного взаимодействия катодных продуктов с анодными газами (44) и реакции Будуара (43) приводит к повышению расхода углерода. При Nсо2 = 0,5 расход будет 0,445 кг/кг.
Величина тс — расход углерода на единицу массы алюминия важна с практической точки зрения, но необходимо иметь в виду, что в ней сочетаются характеристики как непосредственно анодного процесса, состояния и качества анода, так и катодного процесса, поскольку она зависит от количества получаемого алюминия, т. е. от катодного выхода по току. Поэтому для отдельной характеристики анодного процесса полезно ввести величину расхода углерода по току (Ревазян),
под которой понимается расход углерода на 1 А · ч электричества.
Поскольку первичным процессом является реакция (15) с образованием СО2, то расход углерода по этой реакции 0,112 г/(А · ч) будет теоретическим расходом углерода.
Факторы, определяющие расход углерода
Перерасход углерода против теоретического зависит от ряда факторов, связанных как со структурой угольного анода, так и с течением электрохимического процесса на нем.
Качество анода
Перерасход углерода в основном обусловлен осыпанием частиц углерода в электролит с образованием угольной «пены». Этот процесс объясняется неодинаковостью структуры двух видов кокса, из которых состоит анод.
Выше отмечалось, что в структуре анода четко различимы зерна кокса-наполнителя и более активного кокса из связующего. Последний вследствие собственной усадки и расширения зерен кокса-наполнителя подвержен напряжениям, приводящим к образованию множества пор. В процессе окисления (независимо оттого, химическое оно или электрохимическое) зерна кокса-наполнителя не успевают полностью окислиться и переходят в электролит в виде «пены». Чем больше различие в химической активности этих двух составляющих анода, тем больше образуется «пены» и выше расход углерода. Если анод изготовлен из однородного материала — стеклоуглерода, расход углерода оказывается равным теоретическому (Сина Габор).
Наиболее общей характеристикой качества анода является его реакционная способность, т. е. количество выгоревшего углерода с единицы площади электрода в единицу времени, причем под выгоревшим подразумевается не только окислившийся, но и осыпавшийся углерод. В качестве газа-окислителя при лабораторных определениях употребляют СО2 и окисление проводят в цилиндрическом канале.
Между реакционной способностью различных электродных материалов и расходом углерода при электролизе наблюдается корреляционная связь, выражаемая прямой линией (прямая 1 на рис. 24). Вместе с тем показано, что чем ниже реакционная способность и
меньше расход углерода при электролизе, тем выше э.д.с. поляризации (кривая 2 на рис. 24). Здесь играют роль два фактора. Первый — рост реакционной способности, связанный с увеличением реакционной поверхности, что при электролизе приводит к падению фактической анодной плотности тока и уменьшению анодного перенапряжения. Второй — силы связи между атомами углерода в электродном материале: чем они больше, тем выше перенапряжение реакции, поскольку тем труднее происходит отрыв атомов углерода при окислении, но это же вызывает и замедленность горения, т. е. понижает реакционную способность.
Поскольку реакционная способность и расход углерода при электролизе в значительной степени определяются разностью в активностях кокса-наполнителя и кокса из связующего, то один из путей понижения расхода углерода состоит в сближении этих активностей. Следует избегать слишком высоких температур прокалки кокса для приготовления анодной массы, поскольку при этом активность кокса-наполнителя сильно понижается. Вместе с тем непрокаленный кокс не годится, так как при этом повышается электросопротивление анода.
Повышение температуры размягчения пека (применение так называемых высокотемпературных пеков) дает при коксовании пека больше связующего углерода и понижает общую реакционную способность кокса из связующего, т. е. способствует уменьшению расхода
углерода. Другой путь в этом направлении — подбор рационального гранулометрического состава кокса-наполнителя (так называемая сухая шихта). Заводскими испытаниями показано, что увеличение максимального размера крупной фракции с 4 до 10 мм приводит к уменьшению доли связующего и снижает расход углерода при электролизе.
Для уменьшения расхода углерода при электролизе эффективно также применение ингибиторов реакции окисления углерода. Ингибитор сосредоточивается в основном в связующем и, уменьшая активность кокса из-связующего, способствует сближению реакционной способности обоих видов коксов. Наиболее сильное инги-бирующее действие оказывает оксид бора (В2О3). Более слабым ингибитором является фтористый алюминий, но его применение не осложняется некоторыми дополнительными обстоятельствами, как в случае оксида бора (высокая стоимость, трудное отделение пены и др.).
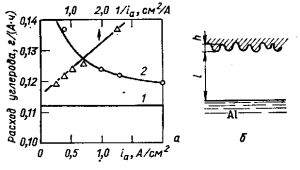
Рис. 25. Зависимость расхода углерода от анодной плотности тока (а), и схема, поясняющая эту зависимость (49) (б): 1 — теоретический расход; 2 — фактический расход; 3 -расход в зависимости от обратной плотности тока (Ведерников, Ветюков)
Условия электролиза
Повышение анодной плотности тока снижает расход углерода в лабораторных ячейках (рис. 25). В первом приближении эту зависимость можно объяснить, исходя из макроструктуры анода. Зерна кокса-наполнителя в анодном процессе образуют выступы на поверхности анода, а кокс из связующего — впадины. На менее активном коксе-наполнителе перенапряжение больше, чем на активном коксе из связующего. Если принять, что поверхности алюминия и анода эквипотенциальны, то падение напряжения между анодом и катодом как для выступов, так и для впадин, одинаково: Uвыс = Uвп. Но для выступов
Uвыс = lρia + ηвыс. (47)
где l — междуполюсное расстояние, см; ρ — удельное сопротивление электролита, Ом · см; ia—плотность тока, А/см2; ηвыс— анодное перенапряжение на выступах, В.
Для впадин Uвп = lρia + hρia + ηвп, где h — средняя высота выступов, см; ηвп— перенапряжение на впадинах, В.
Из этих уравнений следует:
h= Δη/(ρiа), (48)
где Δη — разность перенапряжений между выступами и впадинами, В.
Если считать в первом приближении, что эта разность не зависит от плотности тока, то из выражения (48) следует, что между плотностью тока и высотой неровностей на поверхности анода должна быть обратно пропорциональная зависимость. Приняв, что перерасход анода на осыпание в виде «пены» прямо пропорционален высоте выступов, получим связь между расходом анода qc, г/(А· ч), и плотностью тока ia, А/см2 (Холлиндшед и Браунварц) (рис. 25, прямая 3):
c = a + b/ia. (49)
Значения постоянных а = 0,116 г/(А · ч), b = 0,08 г · см2/(А2· ч).
Для промышленных условий реализуется только начальный участок зависимости qс—ia. При высоких плотностях тока расход углерода начинает повышаться и кривая проходит через минимум при плотностях тока 0,9—0,7 А/см2 (Коробов и Дмитриев). Объясняется это тем, что при высоких iа растет тепловая нагрузка анода, повышается его температура, условия обжига самообжигающегося анода ухудшаются, анод получается менее высокого качества и расходуется больше. Кроме того, повышение температуры боковых граней анода, выступающих из электролита, приводит к большему окислению их, что повышает потери углерода.
Добавки в электролит хлоридов (NaCl, MgCl2 и др.) приводят не только к заметному снижению расхода углерода в процессе электрохимического окисления, но и к уменьшению выгорания боковых граней анода, смоченных электролитом (Щербаков). Предполагается, что ионы Сl— будучи поверхностно активными, адсорбируются на активных местах поверхности анода, что затрудняет разряд ионов кислорода на них. В результате разряд переносится на менее активные зерна кокса-наполнителя, электрохимическое окисление происходит более равномерно, и расход углерода уменьшается. Процесс окисления боковых граней анода, смоченных электролитом, тормозится за счет уменьшения осыпания анода.
Поведение угольных частиц в электролите
Основной источник частиц углерода, поступающих в электролит — несгоревшие зерна кокса-наполнителя. Некоторое количество дисперсного углерода получается и при восстановлении СО растворенным в электролите алюминием (Берсименко): 2Аl+3СО = Al2O3 + 3С.
Частицы углерода легче электролита и при обычных условиях электролиза плохо им смачиваются, поэтому вместе с анодными газами они выносятся из расплава на поверхность электролита, где окисляются СO2 и кислородом воздуха. В электролите содержание взвешенного углерода мало — обычно сотые доли процента по массе при крупности частиц 1—10 мкм (Гротгейм). Однако даже такое малое содержание углерода приводит к заметному падению электропроводимости электролита— до 1%. Причина снижения электропроводимости расплава за счет взвешенных частиц углерода уже рассмотрена в гл. II.
При электролизе могут возникнуть ситуации, при которых отделение угольной «пены» от электролита может быть затруднено. При улучшении смачивания угля расплавом, вызванном повышением криолитового отношения (особенно выше 3) или повышением температуры электролита, задерживается всплывание угольной «пены», вследствие чего электропроводимость расплава понижается, тепловыделения в электролите возрастают и температура его повышается дальше. Процесс развивается спонтанно. Содержание углерода в электролите повышается настолько, что в изломе затвердевшего расплава видны черные включения углерода. Это явление называется науглероживанием электролита.
Если не принять действенные меры (охлаждение электролита, понижение криолитового отношения и др.), то процесс науглероживания может перейти в более
опасную фазу — накарбиживания электролита. Высокие температуры способствуют энергичному растворению-алюминия в электролите и на поверхности углерода начинается реакция карбидообразования: 4Аl+3С = Аl4С3.
Карбид алюминия мало электропроводен, хорошо смачивается электролитом, и всплывание угольных частиц прекращается. При этом температура электролита резко поднимается, карбида получается все больше, и в некоторых местах образуется сплошная масса карбида, замыкающая катод с анодом. В этих местах электролит сильно раскаляется, выделение анодных газов прекращается. В таких случаях приходится полностью или частично заменять электролит свежим.
При нормальном ходе электролиза большие количества «пены» нежелательны. Обычно «пена» сгорает на поверхности электролита, но в тех случаях, когда ее образуется много (на ваннах с верхним токоподводом), сгорание не происходит полностью, и «пену» снимают, что связано с затратами ручного труда и потерями фтористых солей. Хотя снятая «пена» проходит флотацию и часть фтористых солей возвращается в электролиз, часть ее все же теряется с хвостами флотации. Кроме того, флотация требует определенных материальных затрат. Если несгоревшую «пену» своевременно не снимать, она забивается под корку электролита в месте соединения ее с боковым гарниссажем, что может привести к утечкам тока через боковую футеровку электролиза (работа ванны в бока).
Катодный выход по току и потери металла
Катодный выход по току представляет собой отношение практически полученного на катоде металла к теоретическому (по закону Фарадея). Выход по току в алюминиевых электролизерах составляет 83—90%, и проблема повышения этого важного показателя при современных масштабах производства алюминия является весьма важной.
Основной причиной отклонения в выходе по току от 100% является образование субионов алюминия и металлического натрия на катоде. Безразлично, получаются ли ионы Аl+ и натрий в результате электрохимического разряда или взаимодействия алюминия с электролитом, можно говорить о потерях тока на образование
Аl+ и натрия, т. е. о потерях алюминия на растворение его в электролите. Казалось бы, растворение алюминия с образованием субионов Аl+ или металлического натрия, представляющих собой реакцию окисления алюминия, не должно происходить на катодно поляризованной поверхности. Однако необходимо учесть, что в равновесии ток обмена на катоде составляет около 20 А/см2, в то время как катодная плотность тока (т. е. ток поляризации) —всего 0,4—0,5 А/см2. Поэтому при поляризации сдвиг потенциала от равновесного чрезвычайно мал, при этом катодный ток составляет, например, 20,5 А/см2, а анодный — 19,5 А/см2, т. е. анодный процесс идет в значительной степени почти так же, как при равновесии. Поэтому протекание анодных процессов окисления на алюминиевом катоде вполне возможно.
Вследствие циркуляции электролита катодные продукты переносятся к аноду, окисляются здесь газами или электрохимически и безвозвратно теряются. Поэтому практически получаемое количество металла равно теоретическому за вычетом потерь, и выход по току
ηт = 1 — Δm/(γiк) (50)
где %— выход по току, доли ед.; Δm — потери металла, г/(см2· ч); γ — электрохимический эквивалент алюминия 0,3354 г/(А · ч); iK—катодная плотность тока, А/см2. Здесь имеются в виду потери алюминия с 1 см2 поверхности катода в час (Δm), a γiK — количество металла, теоретически образующееся на той же поверхности в то же время.
Вопрос о зависимостях выхода по току от параметров электролиза сводится к установлению зависимости потерь алюминия от этих параметров. Процесс потерь алюминия складывается из следующих стадий: 1) растворение алюминия на межфазной границе электролит — металл; 2) перенос продуктов растворения через при-катодный диффузионный слой; 3) перенос продуктов растворения через толщу электролита вследствие его циркуляции; 4) взаимодействие катодных продуктов с анодными газами или окисление на поверхности анода электрохимическим путем. Эти стадии протекают последовательно одна за другой, поэтому скорость процесса в целом определяется одной (или несколькими) наиболее медленными стадиями.
При такой схеме процесса предполагается, что определяет потери металла поток растворенных катодных
продуктов к аноду. Роль же потока растворенных в электролите анодных газов к катоду невелика. Если сравнить растворимости алюминия и СO2 в электролите, то оказывается, что металла растворяется в 20 раз больше, чем газа (см. рис. 16). Это означает, что с точностью до 5% потоком анодных продуктов к катоду можно пренебречь.
Относительно первой стадии можно сказать, что она протекает очень быстро, поскольку по сути дела это электрохимический процесс окисления, а все электрохимические процессы на алюминиевом электроде в условиях электролиза отличаются высокими плотностями, тока обмена и, следовательно, большими скоростями.
Исследованиями последнего времени (Бегунов, Поляков) показано, что наряду с растворением алюминия в виде субионов происходит процесс образования эмульсии алюминия в электролите — мелких капель, взвешенных в расплаве. В результате быстрого волнообразного движения поверхности металла капли алюминия срываются с гребня волн и попадают в электролит.. Этот вид потерь алюминия зависит не столько от состава электролита, сколько от гидродинамических явлений, происходящих в электролизерах.
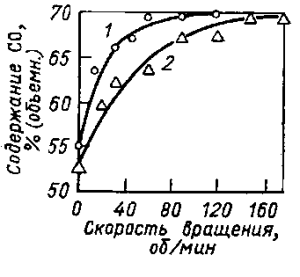
Рис. 26. Влияние скорости вращения мешалки на выход СО при взаимодействии алюминия, растворенного в электролите, с СO2: 1 — чистый алюминий; 2 — сплав алюминия с 50% (по массе) меди
Имеется много экспериментальных данных, указывающих на замедленность стадии переноса растворенного алюминия от катода к аноду. Так, на рис. 26 представлены данные о влиянии перемешивания электролита на взаимодействие алюминия, растворенного в расплаве, с углекислым газом. Жидкий алюминий находился на дне ячейки, газ проходил над поверхностью электролита и поступал на анализ. Большая доля СO2 при этом превращалась в СО. Для чистого алюминия повышение скорости вращения мешалки приводит к: увеличению выхода СО, но при 60 об/мин достигается стационарное состояние, и дальнейшее повышение скорости перемешивания не влияет на выход СО. В этом состоянии уже не скорость переноса, а взаимодействие растворенного алюминия с газом лимитирует процесс.
Если активность алюминия понизить сплавлением с медью, скорость процесса достигнет стационарного значения при скорости вращения приблизительно в два раза большей, чем для чистого алюминия. Этот факт подтверждает мнение, что растворение алюминия на границе металл — электролит не лимитирует скорость всего процесса в целом, поскольку в противном случае стационарный выход СО (при больших скоростях перемешивания) был бы меньше для сплава алюминия с медью, чем для чистого алюминия. Такие большие скорости переноса, как в опытах с перемешиванием в лабораторной ячейке, недостижимы в заводских электролизерах, поэтому можно считать, что процесс потерь алюминия лимитируется стадиями 2 и 3, которые тесно связаны между собой. Применяя 1-й закон Фика к переносу через прикатодный -диффузионный слой, получаем: m = D(C0—С)/б, где D— коэффициент диффузии растворенного алюминия, см2/с; С0 — концентрация его на границе металл — электролит, г/см3; С — то же, на внешней границе диффузионного слоя, г/см3; δ — толщина диффузионного слоя, см.
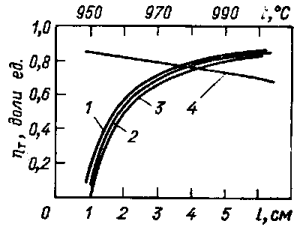
Рис. 27. Зависимости выхода по току от расстояния между электродами (1—3) при 960 °С и температуры (4),построенные в соответствии с уравнением (5/) при анодной плотности тока, А/см2: 1 — 0,75; 2 — 0,65; 3 — 0,55
Концентрация на внешней границе диффузионного слоя, т. е. в перемешиваемом электролите, зависит от скорости циркуляции: чем она больше, тем меньше С. От скорости циркуляции зависит и толщина диффузионного слоя — повышение скорости приводит к уменьшению б. Таким образом, увеличение скорости потоков электролита, обтекающих катод, приводит к повышению потерь алюминия и понижению выхода по току.
Вопрос о влиянии параметров электролиза: плотности тока, расстояния между электродами, температуры, геометрии электролизера является чрезвычайно важным при анализе работы электролизеров. Однако потери металла и выход по току зависят от гидродинамики электролита, от условий массо- и теплообмена в электролизере, от электромагнитных сил, и учесть совокупное влияние всех этих явлений на выход по току не представляется возможным. Известные успехи могут быть достигнуты только моделированием процессов, происходящих в электролизере, на холодных и горячих моделях. Эти работы только начинаются и пока не вышли за рамки исследований отдельных частных вопросов.
Попытка дать эмпирическую формулу для выхода по току была предпринята на основе статистической обработки заводских данных для электролизеров с боковым токоподводом (БТ) и с верхним токоподводом (ВТ) (Коробов с сотр.). Эта формула имеет вид
где ηт— выход по току, доли единицы; sa— площадь анода, м2; ia—анодная плотность тока, А/см2; l — расстояние между электродами, см; t — температура электролита, °С.
Соответствующие зависимости выхода по току для некоторого электролизера с площадью анода 25 м2, рассчитанные по формуле (51), представлены на рис.27.
Зависимость выхода по току от расстояния между электродами можно объяснить следующим образом: с уменьшением этого расстояния при прочих равных условиях сила, действующая на электролит со стороны анодных газов, остается практически неизменной, а масса электролита уменьшается, что приводит к усилению циркуляции электролита и повышению потерь металла. В формуле (51) не учтено то обстоятельство, что начиная с некоторого междуполюсного расстояния, наступает возможность непосредственного контакта между анодными газами и поверхностью металла, который совершает волнообразное движение. Поэтому при малых междуполюсных расстояниях падение выхода по току происходит на самом деле быстрее, чем показывают кривые. По этой причине в заводской практике стараются, чтобы это расстояние находилось в пределах 4— 5 см. Чем больше размер анода, тем это расстояние больше, поскольку возможность замыканий электродов и волнение металла повышаются с увеличением размера анода.
С повышением плотности тока на аноде (и, соответственно, на катоде) увеличивается выход по току. Хотят потери металла возрастают с ростом плотности тока, так как увеличивается скорость циркуляции, но не пря-мопропорционально плотности тока, а слабее, что и приводит, согласно формуле (51), к повышению выхода по току.
Особенно резко влияет на выход по току повышение температуры: процессы диффузии ускоряются с повышением температуры по экспоненте, что учитывается формулой (51), и соответственно увеличиваются потери металла.
Как следует из формулы (51), чем больше площадь анода, тем энергичнее циркуляция электролита и выше потери алюминия.
Кроме рассмотренных факторов, большое влияние на выход по току оказывает состав электролита, особенно криолитовое отношение. При исследовании в лабораторных ячейках потери алюминия минимальны при К.О. 2,4—2,6. При больших К. О. решающую роль играет реакция образования натрия, при малых К. О.— образования субфторида алюминия. Повышение концентрации глинозема приводит к увеличению выхода по току, поскольку растворимость алюминия в электролите при этом падает. Однако следует иметь в виду, что повышение концентрации глинозема выше 7—8% нежелательно, так как в концентрированных расплавах скорость растворения глинозема уменьшается, и большая его-часть при загрузке в электролит попадает в осадки,что нарушает нормальное течение электролиза.
Статья на тему Расход углерода при электролизе алюминия

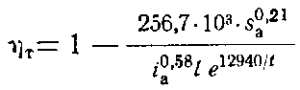
Добавить комментарий
Для отправки комментария вам необходимо авторизоваться.