Структура угольного анода и закономерности горения углерода

Электроны в пространстве между плоскостями легко перемещаются, что определяет высокую электропроводимость вдоль базисной плоскости. Перпендикулярно к плоскостям электропроводимость на несколько порядков ниже.
Угольные материалы — ископаемые угли, коксы и другие отличаются сложным составом, и строением. В основе их структуры лежат базисные графитоподобные сетки — ядра, на периферии которых концентрируются атомы водорода и кислорода, образующие сложные углеводородные соединения — так называемую бахрому. При термической обработке — коксовании происходит разрушение бахромы и рост за счет этого ядра. С повышением температуры ядро перестраивается: кристаллиты укрупняются, и электропроводимость повышается, поскольку сопротивление определяется в
основном границами зерен. Однако термическая обработка коксов не дает возможности достичь структуры идеального графита, даже если она проводится при температурах выше 2000 °С. Получается разупорядоченная структура, состоящая из достаточно крупных кристаллитов графита.
Рис. 18. Кристаллическая решетка идеального графита
Анод алюминиевых электролизеров изготавливают из анодной массы — смеси предварительно прокаленного кокса и пека. Поскольку зола кокса представляет собой смесь оксидов и карбонатов железа, кремния,, кальция и щелочных металлов, то в анодном процессе эти соединения перейдут в электролит, а железо, кремний и другие электроположительные примеси восстановятся в катодном процессе и загрязнят алюминий. Поэтому для изготовления анодов применяют очень чистые, малозольные коксы, полученные при коксовании каменноугольного пека (пековый кокс), или остатки после крекинга нефти (нефтяной кокс).
При обжиге анодов, сформированных из анодной массы, происходит коксование связующего — пека, при: этом зерна кокса — наполнителя (т. е. исходного кокса) прочно связываются коксом из связующего, и получается монолитный, прочный и хорошо проводящий ток электрод. В электролизерах с самообжигающимися анодами этот процесс происходит в самом электролизере, в электролизерах с предварительно обожженными анодами — в специальных печах для обжига.
Несмотря на кажущуюся однородность обожженного анода в его структуре четко прослеживаются две составляющие — зерна кокса-наполнителя и оболочка этих зерен — кокс из связующего. Хотя по своей природе эти материалы могут быть одинаковыми, их внутренняя структура различна. При нагревании зерна кокса-наполнителя лишь расширяются, никаких физико-химических процессов при этом не происходит. Связующее претерпевает процесс коксования — разложения основной массы с выделением летучих и усадкой образовавшегося кокса. При этом получается кокс более рыхлый и пористый, а значит и более реакционно способный, чем кокс-наполнитель. При горении или электрохимическом окислении разница в реакционных способностях этих двух видов кокса приводит к неравномерному окислению, так как зерна кокса-наполнителя не успевают сгорать полностью.
Согласно современной теории горения углерода, реакция окисления происходит через адсорбционно-химический акт. При низких температурах поглощение кислорода поверхностью углерода является физической адсорбцией, природа газа при этом не меняется и при вакуумировании выделяется кислород. С повышением температуры физическая адсорбция переходит в химическую. В молекуле кислорода связи между атомами разрываются, и происходит перераспределение электронных оболочек; между атомами углерода и кислорода возникает связь, подобная химической, причем в ней участвует не один атом углерода, а некоторое перемен-
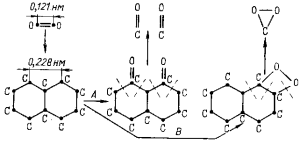
ное их число: образуется неустойчивый промежуточный комплекс СхО. В зависимости от давления кислорода структура’ этих комплексов может быть различной: при малых давлениях образуются комплексы типа кето-групп, при больших — типа пероксидных соединений. Вследствие теплового движения атомов углерода происходит десорбция и разрыв связей внутри решетки графита в первом случае (при пониженном давлении кислорода) — с выделением молекул СО, во втором (при повышенном давлении кислорода)—молекул СО2 (рис. 19).
Рис. 19. Схемы горения графита с образованием промежуточных углерод-кислородных комплексов:
А — с выделением СО, В — с выделением СО2; пунктирные линии — разрыв связей в решетке графита при десорбции
Кроме образования поверхностных комплексов СхО, взаимодействие углерода с кислородом сопровождается заметным растворением кислорода в решетке углерода: экспериментально показано, что кислорода в продуктах горения содержится меньше, чем в исходном газе.
Кинетика горения углерода при температурах около-1000°С, согласно многим работам, определяется скоростью распада промежуточных комплексов, т. е. десорбции продуктов горения.
Анодное перенапряжение
Анодное перенапряжение в лабораторных условиях определяют при поляризации стационарного анода обычно следующим методом: выключают поляризующий ток, и на осциллограмме фиксируется в момент выключения тока потенциал анода относительно электрода сравнения, которым чаще всего служит алюминиевый электрод. Поскольку, как будет показано ниже, первичным анодным газом является СО2, то перенапряжение представляет собой разность между измеренной величиной и равновесным потенциалом угольного электрода, насыщенного углекислотой.
Поляризационные кривые (рис. 20), снятые при 965 °С, К. О. = 2,7, Аl2O3 10% (по массе), показывают, что при промышленных анодных плотностях тока (0,7 —1,0 А/см2) перенапряжение составляет большую величину — от 0,3 до 0,4 В. Поэтому вопрос о природе анодного перенапряжения имеет первостепенное, не только теоретическое, но и практическое значение.
Рис. 20. Анодные поляризационные кривые (Пряхин):
а —в координатах ia—η; б —в координатах η—lgia; материал анода: 1 — пирографит; 2 — графит; 3 — стеклоуглерод; 4 — промышленный анод
Перенапряжение в значительной степени зависит от материала анода: плотный и гладкий пирографит, гексагональные плоскости которого параллельны поверхности анода, дает наибольшее перенапряжение, в то время как стеклоуглерод, обладающий практически беспористой структурой, отличается меньшим перенапряжением, поскольку связь атомов углерода друг с другом в структуре стеклоуглерода значительно слабее, чем в пирографите. Обычный пористый графит дает промежуточные величины перенапряжения (рис. 20, а) и наименьшим перенапряжением характеризуются образцы промышленного анода, которые имеют пористую структуру, а связь между атомами углерода в них менее прочная, чем в решетке графита.
На значительном участке поляризационной кривой для всех материалов соблюдается уравнение Тафеля (рис. 20, б): η = a + blni, причем величина асоставляет 0,420—0,310 В, коэффициент b — 0,255—0,180 В.
Как уже отмечалось, одной из стадий реакции горения углерода является хемосорбция кислорода с образованием СхО. Есть все основания предполагать, что СхО образуется и в процессе электрохимического окисления углерода.
Поэтому анодный процесс можно представить состоящим из следующих последовательно протекающих стадий:
1) транспорт кислородсодержащих ионов, обозначаемых в дальнейшем как Ок2- т. е. ионов кислорода в оксифторидных комплексах, из глубины расплава к поверхности анода: О2-к,э→ О2-к,а , где индекс э —ион в глубине электролита, а — на поверхности анода; 2) окисление ионов кислорода на поверхности угольного анода с образованием промежуточных хемосорбированных комплексов: О2-к,а —2е + хС → СхО; 3) распад промежуточных комплексов (десорбция хемосорбированного кислорода в виде СО2); 2СхО → СО2+(2x— 1)С.
Приведенная схема является простейшей из возможных. Некоторые исследователи, например, считают, что десорбция сопровождается разрядом ионов кислорода на местах, занятых промежуточными оксидами (электрохимическая десорбция): СхO + О2-к,а — 2е → СO2+ (x—1)С. Наиболее медленная стадия определяет скорость всего электрохимического процесса и природу анодного перенапряжения.
Ремпель впервые указал на образование промежуточных оксидов на аноде и замедленность их распада (стадия 3) как причину анодного перенапряжения. Согласно его взглядам, поверхность угольного анода чрезвычайно энергетически неоднородна. При потенциалах, близких к равновесным, кислород сорбируется на наиболее активных центрах, в которых атомы углеродасвязаны с соседними самыми слабыми силами. Поэто-му связь кислород — углерод оказывается самой проч-ной, что отвечает их связи в СО2. По мере роста плот-ности тока в процесс вовлекаются менее активные участки анода, для которых в соединениях СхО силы связи кислород — углерод становятся слабее. Активность кислорода в этих соединениях больше, чем в СО2, и электрохимический потенциал анода сдвигается в положительную сторону. Этот сдвиг будет тем сильнее, чем выше плотность тока. Кроме того, перенапряжение зависит от структуры угольного анода: чем более развита его поверхность, на которой происходит электро-химический процесс, тем меньше фактическая плотность тока и ниже перенапряжение. Важную роль играет также внутренняя структура анода: чем прочнее связь атомов углерода в решетке, тем медленнее десорбция и больше перенапряжение. Как видно на рис. 20, эти со-ображения соответствуют экспериментальным данным. Имеется еще ряд фактов, подтверждающих теорию Ремпеля. При выключении промышленных электролизером каждый из них может служить источником постоянного тока в несколько сотен ампер при напряжении свыше 1,2 В. На аноде (бывшем при электролизе катодом) в этом случае происходит окисление алюминия, на катоде — восстановление кислорода. Подсчеты пока-зывают, что количество кислорода, который расходуется на этот процесс, настолько велико, что он может быть только в виде связанного в соединениях СхО, а не газообразного кислорода.
При выключении лабораторных ячеек и промышленных панн спад потенциала до равновесного значения происходит медленно, в течение долей секунды, что не могло бы быть при условии лимитирующей стадии разряд. (стадия 2).
Импедансные измерения также четко указывают на значительный вклад гетерогенной химической реакции (т. с распада промежуточных оксидов) в общее перенапряжение. Вместе с тем, согласно этим измерениям, на аноде наблюдается заметное перенапряжение диффузии.
Зависимость анодного перенапряжения от концентрации глинозема в электролите (условия опыта i= 1 А/см2, t = 970 °С, К. О. = 2,8) проходит через минимум при концентрации Аl2O3 8% (по массе) (рис. 21). Характерно, что вращение анода снимает значительную часть перенапряжения. Так, при концентрации Аl2O3 около 4% (по массе) перенапряжение уменьшается на 40%; эта часть перенапряжения представляет собой перенапряжение диффузии.
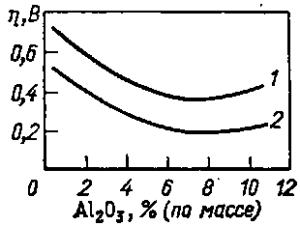
1 — анод неподвижный; 2 — анод.
вращается со скоростью 350 об/мин
Исследования, проведенные с применением импульсной техники (Пряхин), показывают, что при промышленных плотностях тока анодное перенапряжение делится на составляющие следующим образом: перенапряжение реакции 50—55%, перенапряжение диффузии 30—40%, перенапряжение перехода—5—10%. Если пренебрегать последним перенапряжением, то анодный процесс можно рассматривать как равновесный, и разницу между потенциалом без тока и под током можно выразить с помощью уравнения Нернста. Перенапряжение реакции:
где ао(Сх о) — активность кислорода_в хемосорбированных оксидах СxО при поляризации; аO(C хO) — то же для равновесных условий.
Перенапряжение диффузии где а0k,а2- — активность ионов кислорода в приэлектродном слое при поляризации; а0k,а2- —то же для равновесного электрода. Общее перенапряжение:
Соблюдение тафелевской зависимости на большом участке поляризационных кривых (см. рис. 20, б) можно объяснить тем, что основную роль в рассматриваемом процессе играет перенапряжение реакции, подчиняющееся уравнению (37). Вместе с тем имеются два обстоятельства, усложняющие ход поляризационной кривой. Первое — изменение поверхности, доступной для реакции, с ростом поляризации. При малых поляризадиях электрохимический процесс происходит в порах и трещинах анода, поэтому поверхность реакции велика. По мере роста плотности тока микрополости блокируются продуктами анодного процесса и выключаются из реакции, доступная для реакции поверхность уменьшается, а фактическая плотность тока увеличивается. Второе — с ростом плотности тока все большее значение приобретает перенапряжение диффузии. Отклонение от уравнения Тафеля при малых плотностях тока (см. рис. 20, б) объясняется первой причиной, отход поляризационной кривой от прямой вверх при больших плотностях тока — второй.
Зависимость анодного перенапряжения от концентрации глинозема (см. рис. 21) также объясняется с точки зрения перенапряжения реакции и диффузии. Ток обмена реакции i0 в уравнении (37) зависит от концентрации разряжающихся ионов: i0 = nFkCp.
Отсюда видно, что при постоянной плотности тока рост концентрации ионов кислорода o0k,а2- т. е. содержания Аl2O3, приводит к падению перенапряжения реакции. Перенапряжение диффузии также падает с ростом концентрации ионов кислорода, поскольку предельная плотность тока диффузии растет пропорционально этой концентрации.
При больших концентрациях глинозема, когда происходит резкий подъем вязкости (см. рис. 11, б),транспортные затруднения возрастают и перенапряжение диффузии увеличивается, на что показывает минимум на кривой при концентрации глинозема около 8% (по массе).
Остановимся на вопросе о деполяризации анодного процесса катодными продуктами. Если бы растворенный в электролите металл окислялся на поверхности анода только электрохимически и этот процесс проходил бы обратимо, то эффект деполяризации ΔЕДЕП можно было бы сосчитать, исходя из термодинамических данных:
ΔEДЕП=Ep(1-ηT), (42)
где Ер— напряжение разложения глинозема с образованием СО2, В; ηт— выход по току, доли ед.
При величинах концентрации глинозема и температуры, обычных для электролиза, значение ΔЕДЕП будет 0,17 В. Эксперименты показывают, что в лабораторных ячейках деполяризация много меньше — составляет около трети этой величины. Следовательно, растворенный металл только отчасти окисляется на аноде, большая его часть вступает во взаимодействие с анодными газами и реагирует с ними в электролите, что не влияет на потенциал анода.
Сумма напряжения разложения глинозема по реакции (15) и анодного перенапряжения дает э. д. с. поляризации при электролизе. Многочисленные измерения этой величины на промышленных ваннах показывают, что она будет несколько меньше, чем в условиях лабораторного эксперимента, если учитывать все перенапряжение — реакционное и диффузионное. Очевидно, циркуляция на промышленных ваннах, вызванная анодными газами, имеет большее значение, чем в лабораторных ячейках, и часть перенапряжения диффузии при этом снимается.
Анодный эффект
Возникновение анодного эффекта связано с нарушением смачивания электролитом угольного анода: если при нормальном течении электролиза расплав хорошо смачивает поверхность анода и пузырьки газа легко от нее отделяются, то при анодном эффекте газ оттесняет электролит от электрода, образуется пленка газа на аноде, что вызывает резкое повышение напряжения на промышленных ваннах—с 4,0—4,2 В при нормальном электролизе до 40—60 В — при анодном эффекте. В лабораторных ячейках, где трудно достигнуть гальваностатических условий, при ограниченной мощности источника питания возникновение анодного эффекта сопровождается падением силы тока и повышением напряжения.
Анодный эффект в промышленных условиях связан с резким повышением мощности электролизера, приводит к перегреву электролита и нарушению теплового равновесия электролизера. Анодные эффекты вызывают повышение расхода энергии (приблизительно на 1,5%), увеличивают расход фторсолей, что связано с усилением их испарения в результате перегрева электролита, уменьшают катодный выход по току по той же причине. Кроме того, анодные эффекты приводят к неравномерной работе преобразователей тока. Поэтому желательно уменьшение числа анодных эффектов или работа при их отсутствии. Но так как возникновение анодного эффекта связано с обеднением электролита глиноземом, то оно является методом контроля работы ванны, т. е. нормальной выработки глинозема.
Анодная плотность тока, при которой возникает анодный эффект, называется критической. При лабораторных исследованиях было установлено, что критическая плотность тока повышается с ростом концентрации растворенного глинозема (рис. 22, а) и с повышением температуры, и уменьшается с уменьшением криолитового отношения расплава. Анодный эффект характерен для угольных анодов, на других материалах он наблюдается крайне редко. Критическая плотность тока зависит также от структуры анода, но зависимость эта слабая — только на очень рыхлом древесном угле наблюдается заметное снижение критической плотности тока.
Рис. 22. Механизм возникновения анодного эффекта (Беляев): а — зависимость критической плотности тока iKp (1) и краевого угла смачивания в (2) от концентрации глинозема; б — изменение краевого угла смачивания в и поведение газа при выделении на алоде: I — высокая концентрация Аl2О3; II — низкая концентрация Аl2О3; III — анодный эффект; 1 — газ; 2 — угольный анод; 3 — электролит
Несмотря на значительное число работ, посвященных анодному эффекту, механизм его возникновения и течения выяснен недостаточно.
По гипотезе Беляева, главной причиной возникновения анодного эффекта является нарушение смачивания анода электролитом, вызванное обеднением расплава глиноземом. Краевые углы смачивания электролитом угольной поверхности уменьшаются по мере роста концентрации глинозема (рис. 22, а), т. е. смачивание улучшается. Поэтому возникновение анодного эффекта на промышленных ваннах (в гальваностатических условиях) можно представить следующим образом. При больших содержаниях глинозема электролит как бы «отклинивает» пузырек газа, он легко отделяется от поверхности анода, условия для слияния пузырьков отсутствуют (рис. 22, б, I). При малых содержаниях глинозема, когда краевой угол становится большим и смачивание электролитом угольной поверхности ухудшается, пузырьки газа распластываются по поверхности анода и долго на ней удерживаются (рис. 22, б, II). Дальнейшее понижение концентрации глинозема приводит к массовому слиянию пузырьков и возникновению анодного эффекта (рис. 22, б, III).
При неизменной концентрации глинозема и повышении плотности тока (в лабораторных условиях) анодный эффект вызывается тем, что количество пузырьков возрастает и при критической плотности тока они сливаются в сплошной слой — наступает анодный эффект.
Гипотеза Беляева подходит к описанию анодного эффекта с чисто физической стороны — нарушения смачивания анода электролитом. Между тем на аноде происходит ряд сложных электрохимических процессов, играющих определенную роль в возникновении анодного эффекта.
Согласно гипотезе Беляева, трудно объяснить тот факт, что во время анодного эффекта происходит изменение состава анодных газов. Если при нормальном электролизе газ состоит, например, из 25% СО и 75% СO2, то во время анодного эффекта состав газа следующий, % (объемн.): СО 50, СO2 25, CF4 22,5, C2F6 2,5.
Появление фтороуглеродов вряд ли возможно за счет-прямого взаимодействия компонентов электролита, например, AlF3, с углеродом с образованием фтороуглеродов:
4AlF3+3C = 3CF4+ Аl.
Следует признать поэтому, что анодный эффект есть, результат перехода от разряда кислородсодержащих, ионов на аноде к совместному их разряду с фторсодер-жащими ионами. Этот переход возникает вследствие поляризации анода, при которой достигается потенциал для разряда фторсодержащих ионов: 4Fк,a — 4е+С = CF4.
Из термодинамических данных для реакций (19) и (20) следует, что потенциал анода относительно алюминиевого электрода сравнения для этой реакции должен лежать в пределах 2,22—2,52 В (первая цифра — если разлагается фторид алюминия, вторая — криолит;, на самом деле вследствие обогащения анолита фторидом алюминия состав его лежит между этими крайними значениями). Экспериментальное определение потенциала анода во время анодного эффекта дает величины от 2,0 до 2,5 В, т. е. близкие к термодинамическим значениям.
Выше отмечалось, что поляризация анода имеет реакционный и диффузионный характер. С ростом плотности тока или падением концентрации глинозема доля диффузионного перенапряжения возрастает. Переход от-разряда кислородсодержащих ионов к совместному их разряду с фторсодержащими ионами следует объяснить, диффузионным перенапряжением. Таким образом, критическая плотность тока является предельной плотностью тока диффузии. В этом особенно убеждают данные о зависимости критической плотности тока от скорости вращения анода (Дыблин): оказалось, что чем выше скорость вращения, тем больше критическая плотность тока. Пользуясь известными соотношениями между предельной плотностью тока диффузии к вращающемуся дисковому электроду и скоростью его вращения:
id= 0,62nFD2/3ν — 1/6ω1/2C0,
где D — коэффициент диффузии потенциалопределяю-щих ионов, см2/с; ν — кинематическая вязкость электролита, см2/с; ω — скорость вращения, рад/с; С0— концентрация ионов в объеме электролита, моль/см3, можно определить коэффициент диффузии. Его величина 4 · 10-5 см2/с оказалась близкой к значениям, полученным другими методами.
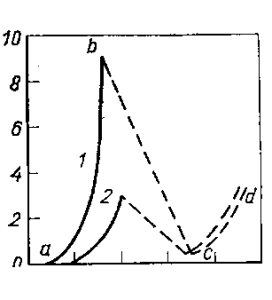
Полные поляризационные кривые, учитывающие разряд как кислородсодержащих, так и фторсодержащих ионов, снять невозможно, поскольку переход от одного процесса к другому происходит практически мгновенно. Однако на основании известного потенциала электрода во время анодного эффекта и отвечающей ему силы тока можно провести гипотетические поляризационные кривые (рис. 23). При больших концентрациях глинозема критическая плотность тока велика.
Уменьшение содержания Аl2O3 приводит к сближению поляризационных кривых для разряда кислородсодержащих и фторсодержащих ионов: первая смещается вправо вследствие уменьшения концентрации глинозема, вторая сдвигается влево за счет роста концентрации криолита. Критическая плотность тока уменьшается. Если криоли-товое отношение электролита понижается (т. е. увеличивается концентрация фтористого алюминия, а значит и фторсодержащих ионов), то происходит сближение поляризационных кривых и критическая плотность тока падает, что и наблюдается в действительности.
Рис. 23. Гипотетические анодные поляризационные кривые: 1— при высоком содержании глинозема; 2 — при низком содержании глинозема; ab — разряд кислородсодержащих ионов; cd — совместный разряд кислород- и фторсодержащих ионов
Такая электрохимическая трактовка анодного эффекта, однако, не объясняет того факта, что возникновение анодного эффекта связано с нарушением смачивания анода электролитом. Можно предполагать, что разряд фторсодержащих ионов происходит так же, как ионов кислорода — через стадию хемосорбции с образованием промежуточных соединений типа CnFm. Распад этих соединений и десорбция CF4 происходит замедленно, что приводит к покрытию поверхности анода соединениями CnFm. Известно, что при взаимодействии фтора с графитом происходит образование ряда фторуглеродов (CF, C4F), которые характеризуются очень низкой электропроводимостью (порядка 0,01 от электропроводимости графита). Возможно, что эти соединения не смачиваются криолитовыми расплавами, и образование их приводит к анодному эффекту. Однако непосредственного доказательства существования подобного рода соединения на поверхности угольного электрода во время анодного эффекта до сих пор не имеется.
Статья на тему Структура угольного анода

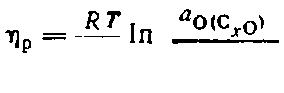
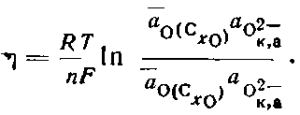
Добавить комментарий
Для отправки комментария вам необходимо авторизоваться.