Обмен веществ клетки — основа процессов жизнедеятельности клетки
Анаболизм создает основу для непрерывного обновления износившихся структур, для поддержания их высокого энергетического уровня.
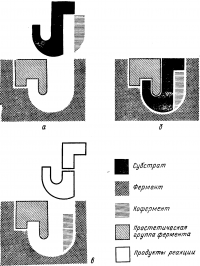
Рис. 6. Схема взаимодействия фермента, субстрата и кофакторов (по С. Роузу)
а — перед началом реакции субстрат, фермент и кофактор сближаются; б — все компоненты ферментативной реакции образуют комплекс, в котором происходит активация молекулы субстрата; в — расщепленная молекула субстрата выходит из активного центра фермента, который готов принять следующую молекулу субстрата.
Энергия для анаболических процессов поставляется реакциями катаболизма, при которых происходит расщепление молекул сложных органических веществ с освобождением энергии. Основное содержание катаболических реакций составляют процессы гидролиза и биологического окисления сложных органических веществ.
Конечные продукты катаболизма — вода, двуокись углерода, ряд азотсодержащих соединений — аммиак, мочевина, мочевая кислота и др. — недоступны для дальнейшего биологического окисления в клетке.
Процессы анаболизма и катаболизма неразрывно связаны. Катаболические процессы осуществляют энергетическое обеспечение анаболических и поставляют для них исходные вещества; анаболические процессы приводят к построению биологических структур, обеспечивающих течение и регуляцию катаболизма, а также поставляют для него изношенные и подлежащие расщеплению макромолекулы.
Роль ферментов в процессах метаболизма. Все процессы метаболизма катализируются и регулируются ферментами — веществами белковой природы.
В условиях лаборатории, чтобы активировать ход химической реакции, реагирующие вещества можно нагреть, повысить давление в системе, если реагенты газы, или добавить щелочь или кислоту, изменив величину рН для реакций, идущих в водных растворах.
Вещества клетки не могут быть подвергнуты подобным воздействиям, так как даже при незначительном изменении величины рН или повышении температуры выше 37° С в ней наступают серьезные изменения, часто приводящие клетку к гибели.
Ферменты являются теми биологическими катализаторами, которые «запускают» реакции в клетке.
Ферменты обладают высокой избирательностью: они ускоряют одни реакции и совсем не действуют на другие, хотя и очень близкие процессы. Некоторые ферменты вступают в реакцию и выходят из нее так быстро, что одна молекула фермента может катализировать превращение полумиллиона молекул за одну минуту.
В живой клетке протекает множество разнообразных реакций. Понятно, что каждая из них катализируется особым ферментом. В большинстве клеток насчитывают свыше двухсот различных ферментов.
Большинство ферментов активно при температуре от 35 до 40° С, что подтверждает их белковую природу. Для большинства ферментов оптимальная среда близка к нейтральной (рН около 7,0), хотя есть и такие, которые наиболее активны в кислой среде или, напротив, в щелочной. Так, фермент слюны амилаза наиболее активен при рН 9,0 и даже выше, а фермент желудочного сока активен при рН 2—3.
Так называемые однокомпонентные ферменты представляют собой чистые белки, а двухкомпонентные состоят из белков и небелковых групп — ионов, витаминов, сложных органических соединений.
Полагают, что фермент, как и любой катализатор, образует временный комплекс с субстратом. При этом высвобождается фермент и образующиеся продукты реакции. Оказывается, истинный комплекс с субстратом образует лишь небольшая часть молекулы фермента, так называемый активный центр, в котором происходит взаимодействие фермента с субстратом, собственно каталитическая реакция.
При определенной величине рН активный центр фермента приобретает строго определенную конфигурацию, которая соответствует структуре субстрата, поэтому молекула субстрата «плотна» укладывается в него, подобно тому как ключ входит в замок (рис. 6). Под действием межмолекулярных сил происходит связывание субстрата с активным центром фермента и активирование его, что приводит к образованию конечных продуктов. Конечные продукты ферментативной реакции уже не заполняют плотно активный центр фермента и «выпадают» из него. Активный центр таким образом высвобождается для катализа новых реакций.
Возможен и такой вариант, когда область активного центра фермента не заполняется полностью молекулой субстрата, и тогда для плотной укладки нужны дополнительно другие вещества. Чаще всего ими являются ионы магния и марганца.
Часто ферменты не способны катализировать реакции без таких дополнительных веществ — активаторов, или коферментов. Иногда кофермент связывается с ферментом так, что их невозможно разделить; тогда кофермент называют простетической группой фермента. И коферменты, и простетические группы выполняют одну и ту же функцию: способствуют связыванию субстрата ферментом.
К настоящему времени известно около 1000 различных ферментов. Строение и механизм действия многих из них изучены. Поэтому классификация ферментов основывается на названиях субстратов (веществ, которые подвергаются их воздействию) и на типах катализируемых ими химических реакций (табл. 3).
Таблица 3
Классификация ферментов
| Названия классов | Катализируемые реакции | Примеры |
| Оксидоредуктазы
Трансферазы Гидролазы |
Окислительно-восстановительные процессыПеренос функциональных групп
Гидролиз |
Каталаза (ускоряет разложение перекиси водорода)Лактатдегидрогенеза (при участии НАД окисляет молочную кислоту до пировиноградной)
Глюкокиназа (переносит остаток фосфорной кислоты с АТФ на глюкозу) Рибонуклеаза (переносит фосфатные группы нуклеотидов на воду, что вызывает деполимеризацию РНК) Аминотрансферазы (переносят аминогруппы с аминокислот на оксикислоты) Липаза (отщепляет остатки жирных кислот от молекул жиров) Пепсин, трипсин (специфически гидролизуют пептиды) АТФ-аза (гидролитически отщепляет остатки фосфорной кислоты от молекул АТФ) Дезоксирибонуклеаза (вызывает гидролитическую деполимеризацию ДНК) Амилиза (гидролизует крахмал гликоген) |
Продолжение табл. 8
| Названия классов | Катализируемые реакции | Примеры |
| ЛиазыИэомеразы
Лигазы (синтета-зы) |
Негидролитическое расщепление с образованием двойных связейИзомеризация
Синтетические процессы за счет АТФ |
Карбонатгидролиаза (расщепляет угольную кислоту на двуокись углерода и воду)Пируватдекарбоксилаза (отщепляет двуокись углерода от пиро-виноградной кислоты)
Цистеиндесульфгидраза (при участии воды отщепляет от цистеина аммиак и сероводород) Триозофосфатизомераза (превращает фосфат глицеринового альдегида в диоксиацетонфосфат) Синтетазы комплексов аминокислоты — РНК Пируваткарбоксилаза (присоединяет двуокись углерода к пировиноградной кислоте) |
АТФ
Анаболические и катаболические процессы не могут осуществляться друг без друга. Их сопряжение обеспечивается благодаря участию АТФ (аденозинтрифосфорной кислоты)—единого и универсального аккумулятора энергии в клетке.
Основу структуры АТФ составляет адениновый нуклеотид (рис. 7). В состав АТФ входят азотистое основание (аденин), сахар (рибоза) и фосфорная кислота. В отличие от обычных нуклеотидов у АТФ вместо одного остатка фосфорной кислоты их содержится три.
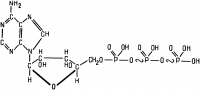
Под влиянием фермента АТФ-азы в молекуле АТФ разрываются связи между Р и О и присоединяется одна (а иногда две) молекула воды. Это сопровождается отщеплением одной (а иногда и двух) молекулы фосфорной кислоты. Если отделяется одна молекула фосфорной кислоты, то образуется аденозиндифосфорная кислота (АДФ). Если отщепляются две молекулы фосфорной кислоты, то АТФ переходит в аденозинмонофосфорную кислоту (АМФ). Так как запас АТФ в клетке ограничен, то сразу же после распада АТФ происходит ее ресинтез.
Гидролиз каждой из двух концевых фосфатных групп протекает с выделением 33 520 Дж, тогда как при отщеплении третьего остатка образуется только 12 570 Дж.
Вследствие этого две концевые фосфатные связи в молекуле АТФ получили название богатых энергией связей или макроэргических. В биохимии макроэргические связи обозначаются знаком ~. Поэтому схематически молекулу АТФ можно изобразить так:
Благодаря макроэргическим фосфатным связям АТФ живая клетка обладает удобной формой хранения энергии, а в случае необходимости эта энергия быстро высвобождается и используется для жизнедеятельности клетки.
Поступление в клетку и гидролиз пищевых веществ. Строение и функции мембран. Поступление в клетку пищевых веществ— необходимое условие осуществления метаболизма. Вещества поступают в клетку через наружную плазматическую мембрану. Чтобы понять функции мембран, надо познакомиться с их химическим составом и строением.
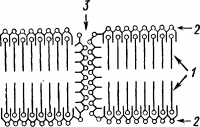
Как показали многочисленные электронно-микроскопические исследования, мембраны клеток трехслойные (рис. 8).Наружный и внутренний слои состоят из молекул белков, расположенных в один ряд. Средний слой образован двумя рядами молекул липидов. Белки и липиды мембраны образуют своеобразные белково-липидные комплексы.
Толщина клеточной мембраны (в зависимости от метода фиксации) 75 — 95 Å.
Молекулы воды свободно проходят через мембраны, вероятно, через поры, выстланные полярными группами. Обмен воды между клеткой и средой зависит только от разности концентраций между ними. На поглощение или удаление воды клетка не затрачивает энергии, перенос воды через мембрану поэтому называют пассивным.
Рис. 8. Схема молекулярной организации цитоплазматической мембраны:
1— бимолекулярный слой липидов; 2 — мономолекулярные слои белка; 3 — пора
Известно, что по законам осмоса через мембраны движется только вода, а за счет электростатических сил — ионы хлора (они связаны со многими катионами и следуют за ними). Транспорт аминокислот, глюкозы, катионов и других веществ совершается через мембраны избирательно, с затратой энергии АТФ и с использованием специальных переносчиков. Такой способ переноса веществ через мембраны наиболее распространен, его называют активным транспортом. Активный транспорт одними и теми же мембранами различных веществ объясняют разнородностью мембран с наличием в них участков, избирательно пропускающих определенные вещества.
Проникновение через мембрану мелких частиц или ионов не сопровождается ее значительными анатомическими изменениями. Иначе попадают в клетку крупные пищевые частицы.
С активной деятельностью цитоплазматической мембраны связаны явления фагоцитоза и пиноцитоза.
Фагоцитоз был открыт И. И. Мечниковым. Суть его — в активном поглощении клеткой относительно крупных частиц. Клетки-фагоциты способны образовывать выпячивания в форме ложноножек, которые обволакивают частицу со всех сторон, и она сначала прикрепляется к наружной мембране клетки, а затем погружается в цитоплазму в «мембранной упаковке». В цитоплазме под влиянием ферментов происходит переваривание и обезвреживание захваченных частиц.
Функцией фагоцитоза у человека обладают лейкоциты, а также клетки-макрофаги лимфатических узлов, селезенки, ретикулярные клетки костного мозга, остеокласты костной ткани. Эти клетки способны захватывать и обезвреживать бактерий, простейших и др.
С фагоцитозом сходен пиноцитоз, при котором через мембрану транспортируются макромолекулярные вещества из водного раствора. Суть пиноцитоза заключается в следующем: некоторые вещества в тканевой жидкости, соприкасаясь с поверхностью клеточной мембраны, оседают на ней (адсорбируются) и тем самым изменяют поверхностное натяжение определенного участка мембраны. Участок мембраны с адсорбированными на нем веществами втягивается внутрь клетки и отшнуровывается. Так адсорбированные вещества оказываются внутри клетки. Целостность мембраны очень быстро восстанавливается.
Попавшие в клетку путем фаго- или пиноцитоза вещества в «мембранной упаковке» поступают в «пищеварительный аппарат» клетки — лизосому, которая представляет собой мембранный мешок, заполненный пищеварительными ферментами. Лизосомы относят к числу универсальных органоидов цитоплазмы. Это небольшие образования длиной 1—3 мкм, округлой формы; их мембрана имеет типичное трехслойное строение. Ферменты, содержащиеся в лизосомах, способны расщеплять (греч. lysis — растворение) белки, нуклеиновые кислоты, полисахариды. Кроме того, за счет ферментов лизосом могут перевариваться при отмирании отдельные структуры клетки, а также целые отмершие клетки.
Особенно богаты лизосомами зернистые лейкоциты (их зернистость не что иное, как скопление лизосом), остеокласты (клетки, обеспечивающие перестройку костной ткани). Именно лизосомам принадлежит решающая роль в формировании функции этих клеток.
В лизосомах происходит первый, подготовительный этап катаболизма. Макромолекулы белков, нуклеиновых кислот, липидов под действием гидролитических ферментов расщепляются на «строительные блоки» (аминокислоты, глюкоза, нуклеотиды), глицерин и жирные кислоты. Некоторое количество энергии, которое при этом освобождается, не используется клеткой и рассеивается.
У многоклеточных животных и человека этот этап метаболизма совершается в основном вне клеток — в органах пищеварения.
Поступившие из лизосом или через наружную мембрану продукты гидролитического расщепления пищевых веществ различными путями перемещаются по цитоплазме, чаще всего они попадают на ферментные системы или в каналы эндоплазматической сети.
Эндоплазматическая сеть открыта сравнительно недавно (1945—1946) с помощью электронного микроскопа. Она представляет собой сложную систему канальцев и цистерн, ограниченных мембранами. Мембраны эндоплазматической сети имеют типичную трехслойную структуру, такую же, как и наружная мембрана клетки.
Во многих клетках на наружной поверхности мембраны эндоплазматической сети располагаются многочисленные гранулы. Это рибосомы. Есть участки эндоплазматической сети, где рибосом нет. В связи с этим различают два типа эндоплазматической сети: гладкую и шероховатую, или гранулярную.
На мембранах эндоплазматической сети расположены ферментные системы, осуществляющие как биологическое окисление и гидролиз поступивших в клетку веществ, так и синтез специальных макромолекул.
Шероховатая эндоплазматическая сеть особенного развития достигает в клетках растущего организма, а также в нервных клетках, клетках, синтезирующих гормоны, ферменты пищеварительных соков. Определенно установлено, что гранулярная эндоплазматическая сеть принимает активное участие в синтезе белков. Этому способствуют располагающиеся здесь рибосомы, высокая концентрация необходимых для синтеза белков рибонуклеиновых кислот и ферментов, катализирующих деятельность всей системы, синтезирующей белок.
Гладкая эндоплазматическая сеть особо развита в клетках, синтезирующих гликоген и липиды (клетки сальных желез, клетки печени). Ферментные системы гладкой эндоплазматической сети осуществляют анаэробный гликолиз и синтез АТФ, синтез углеводов, жиров и жироподобных веществ, а также транспорт углеводов и жиров в полость цистерн, каналов и далее в систему комплекса Гольджи.
Структурно-функциональная организация биологических окислительных процессов
Энергию для анаболических процессов и различных проявлений физиологической активности в животных клетках поставляют биологические окислительные процессы, которые носят многоступенчатый характер. На каждом этапе происходит аккумулирование энергии в молекулах АТФ. Биологическое окисление — основное звено катаболизма — можно подразделить на неполное и полное. Для примера рассмотрим неполное окисление глюкозы (гликолиз). Гликолиз происходит без участия свободного кислорода, поэтому относится к анаэробным процессам.
Реакции гликолиза направляются группой из 11 ферментов, расположенных на мембранах эндоплазматической сети. Попав на первый фермент, глюкоза активируется за счет реакции с АТФ. Продукт этой реакции — глюкозо-6-фосфат — поступает на следующий фермент и т. д. С последнего фермента сходит конечный продукт гликолиза — молочная кислота, а с ряда промежуточных— молекулы АТФ, в которых накопилась энергия неполного окисления. Фактически гликолиз объединяет три группы процессов, в результате которых происходит: 1) разрушение углеродного скелета глюкозы; 2) перемещение остатков фосфорной кислоты из цитоплазмы к промежуточным продуктам гликолиза и, наконец, к АТФ; 3) собственно окислительно-восстановительные реакции — перенос водорода (электронов) от одних промежуточных продуктов к другим.
Молочная кислота — конечный продукт гликолиза — в анаэробных условиях выделяется через мембрану клетки наружу. Когда мышечные клетки высших организмов действуют в условиях перегрузки и вынуждены функционировать в анаэробных условиях, большое количество молочной кислоты поступает в кровь. В печени она вновь превращается в глюкозу. Избыток молочной кислоты в мышцах изменяет величину рН и субъективно воспринимается как их утомление.
В клетках неполному окислению подвергается не только глюкоза, но и глицерин, жирные кислоты, аминокислоты и другие вещества. Один из продуктов этого превращения — пировиноградная кислота (она же предпоследний продукт гликолиза).
В процессе гликолиза освобождается только 5% того количества энергии, которое можно получить от системы глюкоза — кислород. У конечного продукта гликолиза — молочной кислоты— запас химической энергии еще чрезвычайно велик. Дальнейшее извлечение этой энергии происходит при полном, или кислородном, окислении, которое приводит к образованию конечных, энергетически обесцененных продуктов — двуокиси углерода и воды, а также сопровождается синтезом большого количества АТФ.
Полное окисление осуществляется в «энергетических станциях» клетки — митохондриях.
Митохондрии — это обязательные органоиды каждой клетки. Число их в клетке различно: от 2—3 до нескольких тысяч. Это зависит от функционального состояния клетки. Так, при относительном покое в печеночной клетке насчитывают около 900 митохондрий. Прием пищи, вызывающий усиление желчеобразования и желчевыделения, приводит к увеличению числа митохондрий в клетках печени в 1,5—2 раза.
По форме митохондрии могут быть округлыми, овальными, удлиненными, палочковидными или нитевидными., Изменение формы митохондрий происходит при изменении осмотического давления, температуры, рН среды и других воздействиях на клетку.
Электронная микроскопия позволила увидеть сложную структуру митохондрий. Оказалось, митохондрия содержит двухслойную белково-липоидную мембрану, имеющую такое же строение, как и клеточная мембрана. Под внешней мембраной митохондрий располагается внутренняя, которая также имеет типичное строение (рис. 9).
Внутренняя мембрана образует выросты, направленные внутрь митохондрии. Эти выросты называют гребнями или кристами. Кристы увеличивают поверхность митохондрий, что имеет большое значение для направленного осуществления многочисленных химических процессов.
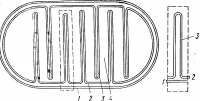
1 — внешняя мембрана митохондрии; 2 — внутренняя мембрана; 3 — складки внутренней мембраны, или кристы; 4 — матрикс
Внутреннее пространство митохондрии, в котором располагаются кристы, заполнено матриксоль.
В составе митохондрий обнаружены белки, липиды и нуклеиновые кислоты, в том числе и ДМК. В митохондриях содержится большое количество ферментов, прижимающих активное участие в энергетическом обмене клетки.
Наружная мембрана в значительной степени проницаема для многих растворимых низкомолекулярных соединений. Во внутреннюю мембрану «встроены» ферментные системы переноса электронов и синтеза АТФ. Внутрь митохондрии непрерывно поступают порции АДФ и промежуточных продуктов биологического окисления. Специальные ферменты-переносчики осуществляют пере движение через митохондриальную мембрану синтезированных молекул АТФ.
Митохондрии расположены в клетке вблизи историков «метаболического топлива» или по соседству от структур, нуждающихся в АТФ. Так, в эпителиальных клетках митохондрии располагаются по направлению движения секрета, для образования которого требуется АТФ. В активна функционирующих мышечных клетках они ориентированы вдоль миофибрилл. Вместе с тем иногда они накапливаются возле жировых включений, используемых как «метаболическое топливо».
Кроме биологического окисления, митохондрии осуществляют разнообразную синтетическую деятельность — в них происходит синтез белков, липидов, углеводов. Имеются данные, указывающие на синтез в митохондриях белков и собственных ДНК, на их генетическую преемственность.
Процессы биологического окисления регулируются как единая система реакций. Избыток АТФ замедляет скорость гликолиза: повышение концентрации АТФ угнетает активность регулятор-
ного фермента гликолитического конвейера — фосфофруктокиназы. Вместе с тем избыточная концентрация АДФ стимулирует активность не только этого фермента гликолиза, но и деятельность митохондрий.
Структурно-функциональная организация анаболических процессов. Биосинтез белков. Синтетические процессы в клетке осуществляются на ферментных системах мембран эндоплазматической сети.
Благодаря локализации ферментных систем на мембранах создаются оптимальные условия для активации и торможения процессов синтеза того или иного вещества, обеспечивается высокая скорость процесса.
В каждой клетке тела животных и растений имеются тысячи различных белков. Синтез белков является самым важным процессом во всей синтетической деятельности клетки. Растущий организм синтезирует белки с большой скоростью. Синтез белков продолжается и после того, как организм перестает расти. Особенно это выражено в клетках специализированных, например пищеварительных желез, синтезирующих белки — ферменты (пепсин, амилаза и др.), или желез внутренней секреции, синтезирующих гормоны, многие из которых являются белками.
Открытие механизма синтеза белков — одно из величайших достижений научного прогресса, не уступающее по своему значению установлению делимости атома в физике.
Белковые цепи построены из сочетаний 20 различных видов аминокислот, связанных друг с другом в уникальной, неповторяющейся последовательности. В цепи каждое аминокислотное звено имеет определенное место. Если распределение аминокислот меняется, то белок теряет свою физиологическую активность или она нарушается.
Основная роль в биосинтезе белков принадлежит нуклеиновым кислотам (ДНК и РНК). ДНК хромосом содержит информацию, необходимую для программирования синтеза всей совокупности специфических белков данного организма. Именно ДНК переносит наследственную информацию от родительской клетки к дочерней.
Запись информации возможна только при наличии кода, состоящего из отдельных «символов». Такими «символами» в молекуле ДНК являются нуклеотиды. В гигантской молекуле ДНК, состоящей из нескольких тысяч последовательно расположенных нуклеотидов, закодирована, зашифрована запись структур ряда молекул белка. Длинная нитевидная молекула ДНК состоит из ряда следующих друг за другом участков. Каждый из них содержит информацию о структуре какого-либо одного белка.
Вспомните азбуку Морзе. В коде Морзе всего два знака (точка, тире). Каждой букве соответствует определенная комбинация точек и тире. Нечто подобное можно видеть и в молекуле
ДНК. Здесь роль кодовых знаков или символов выполняют четыре вида нуклеотидов, многократно повторяющиеся в полинуклеотидной цепи ДНК. Нуклеотиды, как уже говорилось, обозначают начальными буквами названий азотистых оснований: аденина А, тимина Т, гуанина Г и цитозина Ц.
При синтезе белков информация должна содержать данные об аминокислотах, входящих в данный белок, и о порядке их расположения в полипептидных цепях. В белках обнаружено свыше 20 аминокислот, и, следовательно, каждая из них должна быть закодирована в молекуле ДНК определенным сочетанием последовательно расположенных нуклеотидов. Оказалось, каждой аминокислоте соответствует участок ДНК из трех рядом стоящих нуклеотидов. Так, фрагмент А — Ц — Ц соответствует аминокислоте триптофану, участок Т — А — Ц — метионину и т. д.
Таким образом, кодовая группа для каждой из 20 аминокислот состоит из трех нуклеотидов (триплет) (AAA, ГЦГ, ТГА и т. п.). Последовательность расположения аминокислот в структуре белка кодируется на ДНК последовательностью расположения триплетов.
Таких триплетов может быть 64 (это число возможных сочетаний из четырех нуклеотидов по 3).
Итак, ДНК представляет собой основной генетический материал клетки и в конечном счете «отвечает» за белковый синтез.
Но ДНК находится в клеточном ядре, а биосинтез белка происходит в основном в цитоплазме, в мелких структурах ее — рибосомах.
Рибосомы клеток очень малы, имеют округлую форму, их диаметр 150—350 Å. Их можно увидеть только с помощью электронного микроскопа.
Большинство рибосом располагается, как сказано выше, на мембранах шероховатой эндоплазматической сети (клетки печени, поджелудочной железы). В клетках, где шероховатая эндоплазматическая сеть развита слабо, рибосомы свободно располагаются в основном веществе цитоплазмы. Значительное количество свободных рибосом обнаруживается в недифференцированных эмбриональных клетках. Есть рибосомы и в клеточном ядре.
Рибосомы — глобулярные образования, в состав которых входят белок и высокополимерная рибосомальная РНК.
Каким же образом информация передается рибосомам? Это совершается с помощью информационной РНК. Последовательность нуклеотидов в и-РНК отражает структуру одного из участков ДНК. В этом случае говорят, что информация о структуре белков, содержащаяся в молекуле ДНК, как бы переписывается на и-РНК- Этот процесс называют транскрипцией (лат. transcriptio — переписывание).
Молекулы и-РНК транспортируются в рибосомы, где как на матрице происходит сборка белковой молекулы из аминокислот, находящихся в цитоплазме.
В синтезе белков принимают участие различные системы живой клетки. Аминокислоты, идущие на построение белков, вначале активируются в процессе взаимодействия с АТФ, при участии специфичных ферментов.
Активированные аминокислоты переносятся на молекулы растворимых (транспортных) РНК. Для разных видов аминокислот существуют свои т-РНК. Аминокислота присоединяется к т-РНК посредством макроэргической (богатой энергией) связи.
На следующем этапе синтеза активированные аминокислоты переносятся на синтезирующие участки рибосом и т-РНК освобождаются. т-РНК работают подобно челноку, принося активированные аминокислоты в рибосомы и затем покидая их.
т-РНК не только приносят в рибосомы активированные аминокислоты, но и приводят их в контакт с цепочкой и-РНК, где каждая аминокислота «узнается» и удерживается в определенном положении с помощью группировки из трех азотистых оснований. Если кодовый триплет т-РНК окажется комплементарным триплету и-РHK (находящемуся в данный момент в рибосоме), то аминокислота попадает точно в место сборки белка. Аминокислота высвобождается от т-РНК и включается в состав молекулы белка.
Свободная от аминокислоты т-РНК поступает из рибосомы в цитоплазму. Здесь т-РНК снова подхватывает аминокислоту и вновь направляется в одну из рибосом.
К рибосомам из основного вещества цитоплазмы непрерывно поступают с помощью транспортной РНК аминокислоты, из которых синтезируются белковые молекулы.
В рибосомах, находящихся в ядре, происходит синтез ядерных белков.
Молекулы белка, синтезированные на рибосомах, транспортируются по каналам эндоплазматической сети.
Наиболее активная фоль в синтезе белка принадлежит рибосомам, связанным с мембранами эндоплазматической сети. Видимо, эти органоиды представляют связанный друг с другом аппарат синтеза и транспорта белка, продуцируемого клеткой.
Через биосинтез белков осуществляется генетический контроль всех метаболических процессов клетки. Содержащаяся в ДНК наследственная информация реализуется в структурах белков-ферментов и определяет их специфичность, а следовательно, и характер направляемых ими процессов.
Биосинтез белков — процесс, который тщательно регулируется на уровнях транскрипции и трансляции.
Не все молекулы ДНК одновременно участвуют в синтезе белка. Активно функционируют лишь отдельные участки хромосом — пуфы. При образовании пуфа в нуклеопротеидном комплексе ослабевают связи между ДНК и гистонами, осуществляется местная редупликация ДНК, синтез и-РНК, белков и компонентов рибосом.
Комплекс пуфов соответствует набору активных генов. Порядок работы пуфов запрограммирован в генотипе и регулируется системой обратных связей: накопление продуктов деятельности одного пуфа активизирует образование другого.
Продукты биосинтеза накапливаются в клетке в форме включений, капель, вакуолей, кристаллов, гранул. Они непостоянны, в процессе жизнедеятельности клетки могут то возникать, то исчезать.
Многие из включений представляют собой запасные питательные вещества. Таковы капельки жира в клетках подкожной жировой клетчатки животных и человека, клетках печени рыб, цитоплазме инфузорий. В клетках печени, в цитоплазме мышечных волокон содержатся большие скопления гликогена в виде глыбок или зерен.
Белковые включения встречаются в клетках реже, главным образом в цитоплазме яйцеклеток.
К включениям относят и некоторые пигменты клеток, в том числе гемоглобин — дыхательный пигмент, содержащийся в цитоплазме эритроцитов в диффузном состоянии.
Важную роль в образовании включений, в секреторной и синтетической деятельности клеток выполняет один из важнейших органоидов — комплекс Гольджи, который встречается во всех животных и растительных клетках. Во многих клетках комплекс Гольджи действительно имеет форму сложной сети, расположенной вокруг ядра (нервные клетки). Вообще же строение комплекса Гольджи сильно варьирует не только в отдельных клетках, но даже в одной и той же клетке.
В комплексе Гольджи образуются вещества, из которых состоят включения цитоплазмы. Они могут быть в виде капелек жира или зерен белка или углеводов, составляющих запасы питательного или пластического материала клеток.
В секреторных клетках из веществ, поступающих в комплекс Гольджи по каналам эндоплазматической сети, образуются секреторные гранулы. Если секрет гликопротеидной природы, то углеводная часть его молекул синтезируется на мембранах самого аппарата Гольджи.
Полагают, что из поступающих в полости комплекса Гольджи белков и липоидов формируются белково-липоидные комплексы, используемые клеткой для замены стареющих клеточных мембран, мембранных структур самого комплекса Гольджи, шероховатой и гладкой эндоплазматической сети и других мембранных структур клетки.
Статья на тему Обмен веществ клетки

Добавить комментарий
Для отправки комментария вам необходимо авторизоваться.