Физиология возбудимых тканей
Раздражимостью называют способность живых систем под влиянием раздражителей переходить из состояния физиологического покоя в состояние активности. Формы проявления раздражимости весьма разнообразны. У одних клеток при этом изменяются форма, структура, их рост и процесс деления; в других образуются различные химические соединения, совершается та или иная работа, движение.
Раздражителем живой клетки или организма как целого может оказаться любое изменение внешней среды или внутреннего состояния организма, если оно достигает определенной величины.
Среди раздражителей различают физические (температура, укол, давление, свет, звук, электрические раздражители), физико-химические (изменения осмотического давления, активной реакции среды, электролитного состава, коллоидного состояния) и химические (химические вещества пищи, химические соединения, образующиеся в организме,— гормоны, продукты обмена веществ и т. п.).
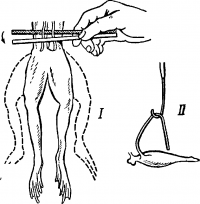
Рис. 17. Первый (I) и второй (II) опыты Гальвани
Естественными раздражителями клеток, вызывающими их деятельность, являются нервные импульсы.
Возбудимость
Клетки нервной и мышечной тканей приспособлены к осуществлению быстрых реакций на раздражение. Клетки этих тканей называют возбудимыми, а их способность отвечать на раздражение возбуждением называют возбудимостью.
Возбуждение способно перемещаться из одного места клетки в другое, из одной клетки в другую.
Возбуждение характеризуется комплексом химических, функциональных, физико-химических, электрических явлений. Обязательным признаком возбуждения является изменение электрического состояния поверхностной клеточной мембраны. Именно электрические явления обеспечивают проведение возбуждения в возбудимых тканях.
Биоэлектрические явления
Возникновение и распространение возбуждения связано с изменением электрического заряда живой ткани, с так называемыми биоэлектрическими явлениями.
Электрические явления у животных известны давно. Еще в 1776 г. они были описаны у электрического ската. Началом же экспериментального изучения электрических явлений в животных тканях следует считать опыты итальянского врача Луиджи Гальвани (1791). В опытах он использовал препараты задних конечностей лягушки, соединенных с позвоночником. Подвешивая эти препараты на медном крючке к железным перилам балкона, он обратил внимание, что, когда конечности лягушки раскачивались ветром, их мышцы сокращались при каждом прикосновении к перилам. На основании этого Гальвани пришел к выводу, что подергивания лапок были вызваны «животным электричеством», зарождающимся в спинном мозге лягушки и передаваемым по металлическим проводникам (крючку и перилам балкона) к мышцам препарата.
Рис. 19. Схема вторичного сокращения.
Против этого положения Гальвани о «животном электричестве» выступил физик Александр Вольта. В 1792 г. Вольта повторил опыты Гальвани и установил, что описанные Гальвани явления нельзя считать «животным электричеством». В опыте Гальвани источником тока служил не спинной мозг лягушки, а цепь, образованная из разнородных металлов — меди и железа.
Вольта был прав. Первый опыт Гальвани не доказывал наличия «животного электричества», но эти исследования привлекли внимание ученых к изучению электрических явлений в живых образованиях.
В ответ на возражение Вольта Гальвани произвел второй опыт, уже без участия металлов. При этом также наблюдалось сокращение лапки лягушки.
Опыт Гальвани. Для этого обездвижьте лягушку и перережьте ее поперек в области верхних грудных позвонков. Захватив остаток позвоночника салфеточкой, снимите с задних конечностей кожу, а затем пинцетом удалите остатки внутренностей. Становятся хорошо видны нервные стволики крестцового сплетения, расположенные с обеих сторон позвоночника пучками. Подведите под оба пучка нервных волокон одну пластинку пинцета Гальвани, а другой пластинкой пинцета прикоснитесь к нервам сверху. Мышцы лапок при этом сокращаются (рис. 17, I). Пинцет Гальвани состоит из цинковой и медной пластинок. Объясните, почему сокращаются мышцы лапок в опыте Гальвани.
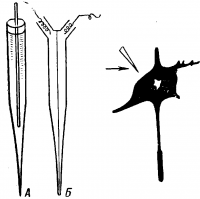
А — одноканальный; Б — двухканальный; справа — кончик электрода около тела нейрона
А теперь приготовьте нервно-мышечный препарат лягушки.
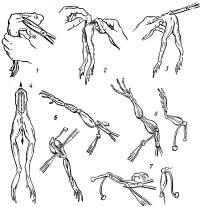
Основные этапы приготовления нервно-мышечного препарата приведены на рисунке 18.
Лягушку обездвижьте. Возьмите ее левой рукой за бедра (в этом положении хорошо выделяется позвоночник) и перережьте позвоночник на 1—1,5 см выше места отхождения тазовых костей (рис. 18, 1). Свисающую переднюю часть туловища и внутренности удалите. Остаток позвоночника крепко держите пинцетом или левой рукой. Другим пинцетом захватите кожу около позвоночника и тяните ее вниз, чтобы, выворачивая, снять с конечностей (рис. 18, 2). Конечности положите на чистую тарелку и залейте раствором Рингера. Руки вымойте или тщательно вытрите от слизи, покрывающей кожу лягушки. Захватите пинцетом или рукой кусочек позвоночника и подогните его вниз так, чтобы конечности висели под углом к позвоночнику и хорошо выделялась копчиковая кость (рис. 18, 3).
Осторожно вырежьте копчиковую кость. Ножницы при этом держите как можно ближе к кости, чтобы не повредить идущие параллельно с обеих сторон нервы. Вырезав копчик, положите препарат на тарелку и разделите его на две половины. Для этого перережьте вдоль сначала остаток позвоночника, а затем лобковое сочленение (рис. 18, 4).
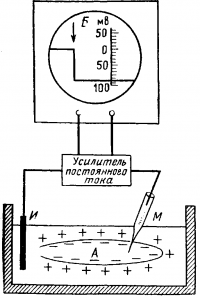
М — микроэлектрод; И — индифферентный электрод. Луч на экране осциллографа Б показывает, что до прокола микроэлектродом мембраны разность потенциалов между М и И была равна нулю. В момент прокола (показан стрелкой) обнаружена разность потенциалов, указывающая, что внутренняя сторона мембраны заряжена электроотрицательно по отношению к ее наружной поверхности.
Одну конечность оставьте как запасную, сохраняя ее в растворе Рингера; другую положите на спинную сторону и отделите ножницами подвздошную кость. Захватив пинцетом кусочек позвоночника, отведите в сторону седалищный нерв и удалите подвздошную кость. При помощи двух пинцетов раздвиньте мышцу на спинной поверхности бедра по средней линии (рис. 18, 5). Осторожно не касаясь ножницами и пинцетом нерва, отделите его от окружающих тканей, вдоль бедра до колен. (Лучше это делать стеклянным крючком.) Нерв отведите в сторону и освободите бедренную кость от мышц (рис. 18, б). На голени отделите от кости икроножную мышцу, подрезав ахиллово сухожилие, и привяжите к нему нитку. Голень и стопу отрежьте ниже колена (рис. 18, 7). Препарат положите в стакан с раствором Рингера.
Проделайте второй опыт Гальвани (сокращение без металла). Для этого нервно-мышечный препарат положите на дощечку. Отрежьте кусочек мышцы и стеклянным крючком быстро набросьте нерв препарата на пораненный участок мышцы так, чтобы он одновременно коснулся поврежденной и неповрежденной поверхности мышцы (рис. 17, II). Мышца при этом сокращается. Объясните, почему это происходит.
Гальвани все же оказался прав в своем утверждении о существовании «животного электричества», что позже было подтверждено исследованиями других ученых.
В этом отношении интересны опыты Маттеучю, получившие название вторичного сокращения.
На мышцу одного нервно-мышечного препарата набросьте нерв другого нервно-мышечного препарата (рис. 19) и раздражайте электрическим током нерв первого препарата. Вы наблюдаете сокращение мышцы и второго препарата. Это объясняется тем, что при возбуждении в мышце первого препарата возникают токи действия, которые вызывают возбуждение второго нервно-мышечного препарата.
В дальнейшем в изучение биоэлектрических явлений очень важный вклад внесли русские ученые, среди них И. М. Сеченов, обнаруживший с помощью гальванометра электрические явления в головном мозге, Н. Е. Введенский, А. Ф. Самойлов и др.
В настоящее время имеются весьма совершенные, высокочувствительные приборы (электронно-лучевые трубки с электронными усилителями), позволяющие регистрировать электрические явления в тканях и органах.
Потенциал покоя и потенциал действия мышц
Между наружной поверхностью клетки и ее цитоплазмой в состоянии покоя существует разность потенциалов около 60—90 мВ, причем поверхность клетки заряжена электроположительно по отношению к цитоплазме. Эту разность потенциалов называют потенциалом покоя или мембранным потенциалом. Точное измерение потенциала покоя возможно только с помощью микроэлектродов, предназначенных для внутриклеточного отведения токов, очень мощных усилителей и чувствительных регистрирующих приборов — осциллографов.
Микроэлектрод (рис. 20) представляет собой тонкий стеклянный капилляр, кончик которого имеет диаметр около микрона. Этот капилляр заполняют солевым раствором, погружают в него металлический электрод и соединяют с усилителем и осциллографом (рис. 21). Как только микроэлектрод прокалывает покрывающую клетку мембрану, луч осциллографа отклоняется вниз из своего исходного положения и устанавливается на новом уровне. Это свидетельствует о наличии разности потенциалов между наружной и внутренней поверхностью клеточной мембраны.
Наиболее полно происхождение потенциала покоя объясняет так называемая мембранно-ионная теория. Согласно этой теории все клетки покрыты мембраной, имеющей неодинаковую проницаемость для различных ионов. В связи с этим внутри клетки в цитоплазме в 30—50 раз больше ионов калия, в 8—10 раз меньше ионов натрия и в 50 раз меньше ионов хлора, чем на поверхности клетки. В состоянии покоя клеточная мембрана более проницаема для ионов калия, чем для ионов натрия.
Диффузия положительно заряженных ионов калия из цитоплазмы на поверхность клетки придает наружной поверхности мембраны положительный заряд.
Таким образом, поверхность клетки в покое несет на себе положительный заряд, тогда как внутренняя сторона мембраны оказывается заряженной отрицательно за счет ионов хлора, аминокислот и других крупных органических анионов, которые через мембрану практически не проникают.
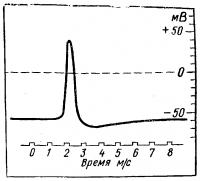
Если участок нервного или мышечного волокна подвергнуть действию достаточно сильного раздражителя, то в этом участке возникает возбуждение, проявляющееся в быстром колебании мембранного потенциала и называемое потенциалом действия.
Потенциал действия можно зарегистрировать с помощью электродов, приложенных к внешней поверхности волокна (внеклеточное отведение), либо микроэлектрода, введенного в цитоплазму (внутриклеточное отведение) (рис. 22).
При введении микроэлектрода в нервное волокно сначала регистрируется потенциал величиной около 60 мВ. Это мембранный потенциал.
Потенциал действия представляет собой резкий скачок мембранного потенциала. При этом происходит не только изменение отрицательного потенциала покоя от величины — 60 мВ до нуля, но и переход за нулевую линию на несколько десятков милливольт, так что амплитуда потенциала действия превышает потенциал покоя и составляет приблизительно 90 мВ.
В потенциале действия различают его пик (спайк, по терминологии английских авторов) и следовые потенциалы. Во время пика мембранный потенциал меняет свой знак.
Причина возникновения потенциала действия — изменение ионной проницаемости мембраны. При раздражении проницаемость клеточной мембраны для ионов натрия повышается. Натрий стремится внутрь клетки, так как, во-первых, он заряжен положительно и его влекут внутрь электростатические силы, вовторых, концентрация его внутри клетки невелика. В покое клеточная мембрана была малопроницаемой для этого иона. Раздражение изменило проницаемость мембраны, и поток положительно заряженных ионов натрия из внешней среды клетки в цитоплазму значительно превысил поток ионов калия из клетки наружу. В результате произошло извращение потенциала мембраны (фаза деполяризации). Внутренняя поверхность мембраны стала заряженной положительно, а наружная вследствие потери положительно заряженных ионов натрия — отрицательно. В этот момент и регистрируется пик потенциала действия.
Повышение проницаемости мембраны для ионов натрия продолжается очень короткое время. Вслед за этим в клетке возникают восстановительные процессы, приводящие к тому, что проницаемость мембраны для ионов натрия вновь понижается, а для ионов калия возрастает. Поскольку ионы калия также заряжены положительно, то, выходя из клетки, они восстанавливают исходные отношения снаружи и внутри клетки (фаза реполяризации).
Накопления натрия внутри клетки при многократном возбуждении ее не происходит, потому что натрий эвакуируется из нее постоянно за счет действия специального биохимического механизма, называемого «натриевым насосом». Есть данные и об активном транспорте калия с помощью «натрий-калиевого насоса».
Таким образом, согласно мембранной теории в происхождении биоэлектрических явлений решающее значение имеет избирательная проницаемость клеточной мембраны, обусловливающая разный ионный состав на поверхности и внутри клетки, а следовательно, и разный заряд этих поверхностей. Следует заметить, что многие положения мембранной теории все еще дискуссионны и нуждаются в углубленной разработке.
Итак, биоэлектрические свойства клеток, обусловленные неравномерным распределением минеральных ионов, играют ведущую роль в процессах клеточного возбуждения. Возникновение потенциала действия является наиболее характерным показателем возбуждения в клетках, тканях и органах. Поэтому электрофизиологические исследования широко применяются в экспериментальных лабораториях и в клиниках.
Значение регистрации биоэлектрических явлений. Регистрация электрических потенциалов в живом организме дает возможность судить об изменениях многих физиологических функций. Так как электрическая активность многих органов человека в норме имеет типичные и постоянные характеристики, то методы электрофизиологии широко используются для диагностики болезней в практической медицине. Большие успехи достигнуты в тонком распознавании болезней сердца, нервной системы, мышц. Электрофизиологические методы сыграли важную роль в решении многих проблем космической физиологии. С помощью методов телеметрии оказалось возможным передавать информацию о состоянии сердечной мышцы, деятельности мозга, скелетной мускулатуры и других органов в условиях невесомости, перегрузок.
Изучение электрической активности центральной нервной системы легло в основу конструирования сложных счетно-решающих электронных машин.
Под электроэнцефалографией понимают запись биоэлектрических явлений, протекающих в головном мозге, преимущественно в коре больших полушарий головного мозга.
Для отведения биотоков от различных структур головного мозга используют различные конструкции электродов. В эксперименте на животных электроды можно ввести через кости черепа прямо в нужный участок головного мозга. Такие «вживленные» электроды долго удерживаются в мозгу специальным креплением и позволяют изучать электрическую активность определенных участков головного мозга при различных состояниях животного.
В настоящее время возможна длительная регистрация электрических явлений даже в отдельных клетках мозга с помощью микроэлектродов.
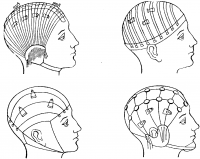
При записи биотоков мозга человека — электроэнцефалограммы — пользуются обычно серебряными электродами, имеющими вид пластинки размером с двухкопеечную монету. Электроды на голове испытуемого человека укрепляются с помощью шлемов-сеток. Шлемы изготовляют из эластичных резиновых тяжей, натяжение которых регулируют. Шлемы, плотно прилегая к голове испытуемого, надежно удерживают электроды (рис. 23).
Запись биотоков мозга производится на приборах — электроэнцефалографах, имеющих разную конструкцию и включающих несколько усилителей биотоков, осциллографы и сложный пульт управления ими.
В настоящее время выпускают приборы, позволяющие регистрировать одновременно электрическую активность от 2 до 32 точек мозга и более.
Для точного анализа электрических явлений, возникающих в головном мозге и других органах, используют электронно-вычислительные машины.
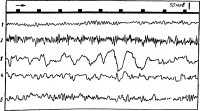
Электрическая активность мозга человека носит ритмический характер. Электроды, расположенные на поверхности головы, дают возможность зарегистрировать биотоки сразу от многих клеток мозга, лежащих под ними. Поэтому общий характер энцефалограммы оказывается очень сложным. Вместе с тем удалось установить, что наиболее выраженных и часто встречающихся ритмов колебания электрической активности немного. Названия этих ритмов условно обозначены греческими буквами α, β, δ, ϑ (рис. 25, табл. 4).
Таблица 4
Ритмы электроэцефалограммы
| Название ритма | Частота колебаний в 1 с |
| Дельта-ритм
Тета-ритм Альфа-ритм Бета-ритм |
0,5— 3
4— 7 8—13 14—35 |
1 —альфа-ритм- 2 — бета-ритм; 3 — дельта-ритм; 4-тета-ритм; 5-веретена; вверх у — отметка времени
При ограниченном поступлении центростремительных импульсов в исследуемый участок мозга обычно наблюдаются медленные волны с большим размахом колебаний. Если в кору поступают многочисленные импульсы, то клетки в этом участке могут находиться в разных стадиях возбуждения и общая электрическая активность над этим участком характеризуется частыми колебаниями с небольшой амплитудой типа бета-ритма. На рисунке 26 приведена электроэнцефалограмма с затылочной области коры (там располагается зрительная зона коры больших полушарий). На ней отчетливо виден переход альфа-ритма в бета-ритм и обратно при открывании и закрывании глаз, т. е. при увеличении и снижении потока центростремительных импульсов к зрительной зоне коры.
Современная техника позволяет регистрировать энцефалограмму у человека на расстоянии и даже в условиях космического полета.
Получил достаточно широкое распространение и метод исследования электрической активности мышц — электромиография.
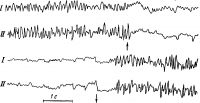
Рис. 26. Изменения электроэнцефалограммы затылочной области коры, показывающие переход от альфа-ритма к бета-ритму при открывании глаз (стрелка вверх) и восстановление альфа-ритма при закрывании глаз (стрелка вниз).
На рисунке 27 представлены электромиограммы трехглавой и двуглавой мышц плеча при работе напильником. На них отчетливо видно усиление колебаний при возбуждении мышц. Электромиография позволяет установить степень участия тех или иных мышц в выполняемом движении. Особенно важен этот метод для установления наличия паралича мышц при некоторых заболеваниях. Так, с помощью электромиографии можно обнаружить паралич дыхательных мышц при полиомиелите до того, как остановится дыхание. А это очень важно для принятия необходимых мер (перевод на управляемое дыхание с помощью специальной аппаратуры) с целью спасения жизни человеку.
Рис. 27. Электромиограммы трехглавой (1) и двуглавой (2) мышц плеча у рабочего при опиловке.
Данные электромиографии используются при создании активных протезов и управляемых манипуляторов.
«Искусственная рука» — одно из первых устройств, управляемых с помощью биотоков мышц. Это активный протез, воспроизводящий нормальные движения кисти. Такой активный протез имеет браслет для отведения биотоков мышц сохранившейся культи. На браслете укреплены металлические чашечки, заполненные токопроводящей пастой. Отводимые с помощью браслета мышечные токи усиливаются и поступают в специальный блок на протезе, где формируется управляющий сигнал. Сигнал приводит в действие миниатюрный двигатель, который обеспечивает движение протеза. Сам протез выполняется из пластических материалов, сходных по форме, размерам и цвету с нормальной рукой.
Передача возбуждения в синапсах
Возбуждение от одной нервной клетки к другой или от нервного волокна к мышечной или железистой клетке передается с помощью синапсов.
Аксоны большинства нейронов, подходя к другим нервным клеткам, ветвятся и образуют многочисленные окончания на телах этих клеток и их дендринах (рис. 28). Такие места контактов называют синапсами.
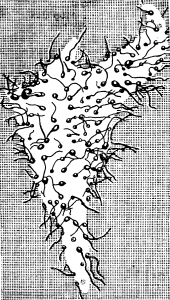
Количество синапсов на теле одного нейрона достигает 100 и больше, а на дендритах одного нейрона — нескольких тысяч. Одно нервное волокно может образовать до 10 000 синапсов на многих нервных клетках.
Синапс имеет сложное строение (рис. 29). Он образован двумя мембранами — пресинаптической и постсинаптической, между которыми есть синоптическая щель. Пресинаптическая мембрана находится на нервном окончании. Нервные окончания в центральной нервной системе имеют вид пуговок, колечек или бляшек. На теле пирамидной клетки насчитывается несколько тысяч нервных окончаний. Каждая синаптическая пуговка покрыта пресинаптической мембраной. Постсинаптическая мембрана находится на теле или дендритах нейрона, к которому передается нервный импульс. В пресинаптической области обычно наблюдаются большие скопления митохондрий.
Возбуждение через синапсы передается химическим путем с помощью особого вещества — посредника, или медиатора, находящегося в синаптической бляшке. В синаптической бляшке медиатор находится в синаптических пузырьках, каждый из которых содержит до 2000 молекул медиатора. В разных синапсах вырабатываются разные медиаторы. Чаще всего в качестве медиатора служит ацетилхолин, адреналин или норадреналин в некоторых синапсах — глютаминовая кислота.
Каков же механизм передачи возбуждения в синапсах? Приход нервного импульса в пресинаптическое окончание сопровождается синхронным выбросом в синаптическую щель медиатора из синаптических пузырьков, расположенных в непосредственной близости от нее. Размеры этой щели очень малы (около 200 Å), и медиатор, быстро достигая постсинаптической мембраны, взаимодействует с ее веществом. В результате этого взаимодействия структура постсинаптической мембраны временно изменяется, проницаемость ее для ионов натрия повышается, что приводит к перемещению ионов и, как следствие, появлению возбуждающего постсинаптического потенциала. Когда этот потенциал достигает определенной величины, возникает распространяющее возбуждение — потенциал действия.
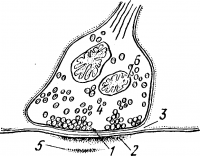
1 — пресинаптическая мембрана; 2 — постсинаптическая мембрана; 3 — синаптическая щель; 4 — синаптические пузырьки; 5 — нейропротофибриллы; 6 — митохондрии.
Через очень короткое время (несколько миллисекунд) медиаторы разрушаются специальными ферментами.
В настоящее время подавляющее большинство нейрофизиологов признает существование в спинном мозге и в различных отделах головного мозга двух качественно различных типов синапсов — возбуждающих и тормозящих. Полагают, что в специализированных тормозящих нейронах, в нервных окончаниях аксонов вырабатывается особый медиатор, оказывающий тормозящее воздействие на последующий нейрон. Природа этого медиатора еще окончательно не установлена. В коре больших полушарий таким медиатором некоторые авторы считают гамма-амино-масляную кислоту.
Под влиянием приходящего по аксону тормозящего нейрона импульса в синаптическую щель выделяется медиатор, который вызывает специфические изменения в постсинаптической мембране. Суть этих изменений состоит в том, что медиатор торможения, взаимодействуя с веществом постсинаптической мембраны, увеличивает ее проницаемость для ионов калия и хлора. Внутри клетки относительно увеличивается число анионов. В результате происходит не снижение величины внутреннего заряда мембраны (как это имеет место в возбуждающем синапсе), а повышение внутреннего заряда постсинаптической мембраны. Это ведет к возникновению тормозного постсинаптического потенциала, в результате чего наступает торможение.
В каждой нервной клетке расположено множество возбуждающих и тормозных синапсов. Это создает условия для их взаимодействия.
Статья на тему Физиология возбудимых тканей

Добавить комментарий
Для отправки комментария вам необходимо авторизоваться.