Электронная структура атомов — это организация электронов вокруг атомного ядра, описывающая их расположение по энергетическим уровням, подуровням и орбиталям.
Она определяет химические свойства элемента.
Валентность фтора — это способность образовывать в соединениях химические связи.
То есть: фтор всегда проявляет валентность, равную .
Причина валентности фтора, равной
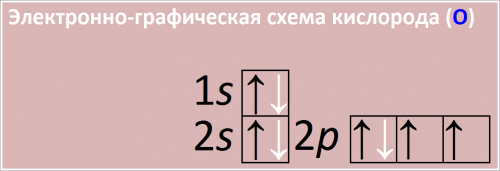
Например, атом кислорода (O).
Порядковый номер: Кислород имеет порядковый номер 8 в Периодической таблице.
Это означает, что у нейтрального атома кислорода 8 электронов.
Распределение электронов:
1s2: На первом энергетическом уровне (K-слой), на s-подуровне, находятся 2 электрона.
2s2: На втором энергетическом уровне (L-слой), на s-подуровне, находятся 2 электрона.
2p4: На втором энергетическом уровне (L-слой), на p-подуровне, находятся 4 электрона.
Электронная структура атомов и периодический закон
Закономерности в изменении свойств элементов, наблюдаемые при переходе от элемента к элемент.
А также кажущиеся с первого взгляда неправильности в периодической системе.
Например, различное число элементов в периодах, большое сходство четырнадцати так называемых редкоземельных элементов и др.
Являются следствием изменения строения электронных оболочек атомов.
Поэтому прежде чем переходить к дальнейшему изложению, необходимо познакомиться с расположением электронов в атомах всех химических элементов.
И проследить, пользуясь таблицами, как идет нарастание электронных слоев и заполнение их электронами с увеличением порядковых номеров элементов.
Электронное заполнение в малых периодах (1-3)
В главах, посвященных первым восемнадцати элементам Периодической системы (элементам трех малых периодов), мы уже рассматривали схемы строения их атомов.
Напомним, что заполнение электронных слоев в атомах этих элементов происходит совершенно равномерно с увеличением порядковых номеров.
В атоме каждого следующего элемента добавочный электрон становится в наружный слой или, если этот слой уже заполнен, начинает собой новый слой.
Например, у 18-го элемента — аргона (Ar) — электронная конфигурация выглядит так:
- Первый слой (K) содержит 2 электрона.
- Второй слой (L) содержит 8 электронов.
- Третий слой (M) также содержит 8 электронов.
Что можно записать следующим образом:
Особенности заполнения в больших периодах (4-5)
Заполнение электронных слоев в атомах элементов больших периодов, как показывают спектроскопические данные, протекает несколько сложнее (см. табл. 8).
Так как для наружного слоя предельное число электронов равно восьми, то, хотя в слое М может находиться 18 электронов, у первого элемента четвертого периода — калия (№ 19) появляется новый слой N с одним электроном.
В атоме кальция (№ 20) к слою N добавляется еще один электрон. На этом заполнение слоя N электронами временно приостанавливается.
Начиная с скандия (№ 21), вплоть до меди (№ 29), стоящей в начале второй половины четвертого периода, постепенно заполняется электронами слой М, в то время как в наружном слое N число электронов сохраняется равным двум, а в атомах хрома и меди даже уменьшается до одного.
В атоме меди слой М содержит 18 электронов, а слой N — один электрон
Только теперь, когда слой М достроен (так как число электронов в нем достигло предельной величины).
Происходит равномерное заполнение электронами слоя пока число электронов в нем не достигнет восьми у инертного газа криптона (№ 36):
Заполнение электронных слоев в атомах элементов пятого периода, начиная с рубидия (№ 37) и кончая инертным газом ксеноном (№ 54), происходит так же, как и в атомах, находящихся в четвертом периоде.
Поэтому атом ксенона имеет строение:
Шестой Период и лантаниды: глубинное заполнение
Шестой период содержит 32 элемента.
Следовательно, при переходе от ксенона (№ 54) к следующему инертному газу — радону (№ 86) должно прибавиться 32 электрона.
Распределение их по слоям происходит в следующем порядке.
Начиная с цезия (№ 55), идет построение шестого электронного слоя Р; следующий за цезием элемент барий (№ 56) имеет в слое Р два электрона:
На этом, как и в двух предыдущих периодах, построение наружного слоя временно прекращается.
У элемента лантана (La, № 57) новый электрон поступает в слой О:
За лантаном следуют редкоземельные элементы или лантаниды (№ 58-71).
В атомах этих элементов число электронов в наружном слое Р сохраняется таким же, как в атоме бария, но идет достройка слоя N до 32 электронов.
Этот процесс заканчивающаяся у элемента № 70 — иттербия.
После этого, начиная с лютеция (№ 71) и до конца шестого периода, заполнение слоев электронами идет в общем так же, как и в двух предыдущих больших периодах.
То есть сперва заполняется слой О до 18 электронов (элемент № 79), затем электроны поступают в слой Р, пока число их в этом слое не достигнет восьми у инертного газа радона (№ 86) :
Седьмой период и общие принципы
В седьмом периоде начинается построение нового электронного слоя Q, которое заканчивается у второго члена периода — радия (№ 88).
В атоме следующего за ним элемента — актиния — новый электрон поступает уже в слой Р.
После тория идет заполнение электронами глубже лежащего слоя О аналогично тому, как это происходило в шестом периоде в атомах лантанидов.
Таким образом, в каждом периоде идет построение нового электронного слоя, а в больших периодах, кроме того, достройка внутренних слоев.
Отсюда следует важное правило: число электронных слоев в атоме равно номеру периода, в котором находится соответствующий элемент .
Влияние на структуру Периодической системы
Выяснение строения электронных оболочек атомов оказало влияние и на самую структуру периодической системы, несколько изменив существовавшее до тех пор деление элементов на периоды.
В прежних таблицах нулевая группа ставилась перед первой и каждый период начинался с инертного газа, причем водород оставался вне периодов.
Но теперь стало ясно, что новый период должен начинаться с того элемента.
В атоме которого впервые появляется новый электронный слой в виде одного валентного электрона (водород и щелочные металлы).
И заканчиваться тем элементом, в атоме которого этот слой имеет восемь электронов, образующих очень прочную электронную группировку, свойственную инертным газам.
Такое естественное разделение элементов на периоды и привело к построению той таблицы и в которой нулевая группа помещается после седьмой группы с правой стороны таблицы .
Теория строения атомов разрешила также вопрос о положении в периодической системе редкоземельных элементов (лантанидов№58—71).
Которые ввиду их большого сходства друг с другом нельзя было поместить в различные группы таблицы.
Данные показывают, что атомы этих элементов отличаются друг от друга строением одного из глубже лежащих электронных слоев.
В то время как число электронов в наружном слое, от которого главным образом зависят химические свойства элемента, у них одинаково.
По этой причине все редкоземельные элементы (лантаниды) помещены теперь вне общей таблицы, а в клетке для элемента № 57 (La) отмечено лишь их положение в периодической системе.
Физический смысл периодического закона
Но основное значение теории заключалось в раскрытии физического смысла периодического закона, который во времена Менделеева был еще неясен.
Достаточно взглянуть на таблицу расположения электронов в атомах химических элементов, чтобы убедиться, что с увеличением зарядов атомных ядер постоянно повторяются одни и те же комбинации электронов в наружном слое атома.
Таким образом, периодическое изменение свойств химических элементов происходит вследствие периодического возвращения к одним и тем же электронным группировкам.
Это объясняет, почему элементы, находящиеся в одной группе, обладают схожими химическими свойствами – у них одинаковое число валентных электронов.
Часто задаваемые вопросы
Это распределение электронов по энергетическим уровням, подуровням и орбиталям вокруг атомного ядра.
Это формула, которая показывает распределение электронов по энергетическим уровням, подуровням и орбиталям в атоме.
Электрон атома — это стабильная элементарная частица с отрицательным электрическим зарядом, которая вращается вокруг положительно заряженного ядра атома.
Его основные характеристики:
Заряд: −1,602 × 10−19 Кулона (это так называемый элементарный электрический заряд).
Масса: 9,109 × 10−31 килограмма (она очень мала, примерно в 1836 раз меньше массы протона).

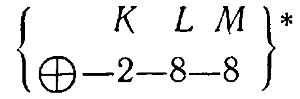
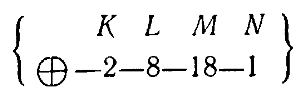
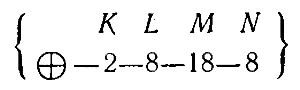
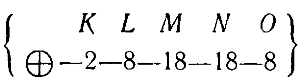
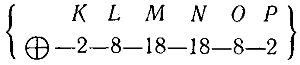
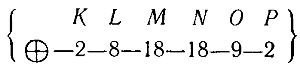
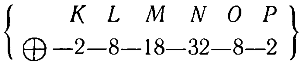
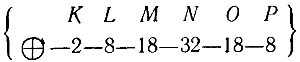
Добавить комментарий
Для отправки комментария вам необходимо авторизоваться.