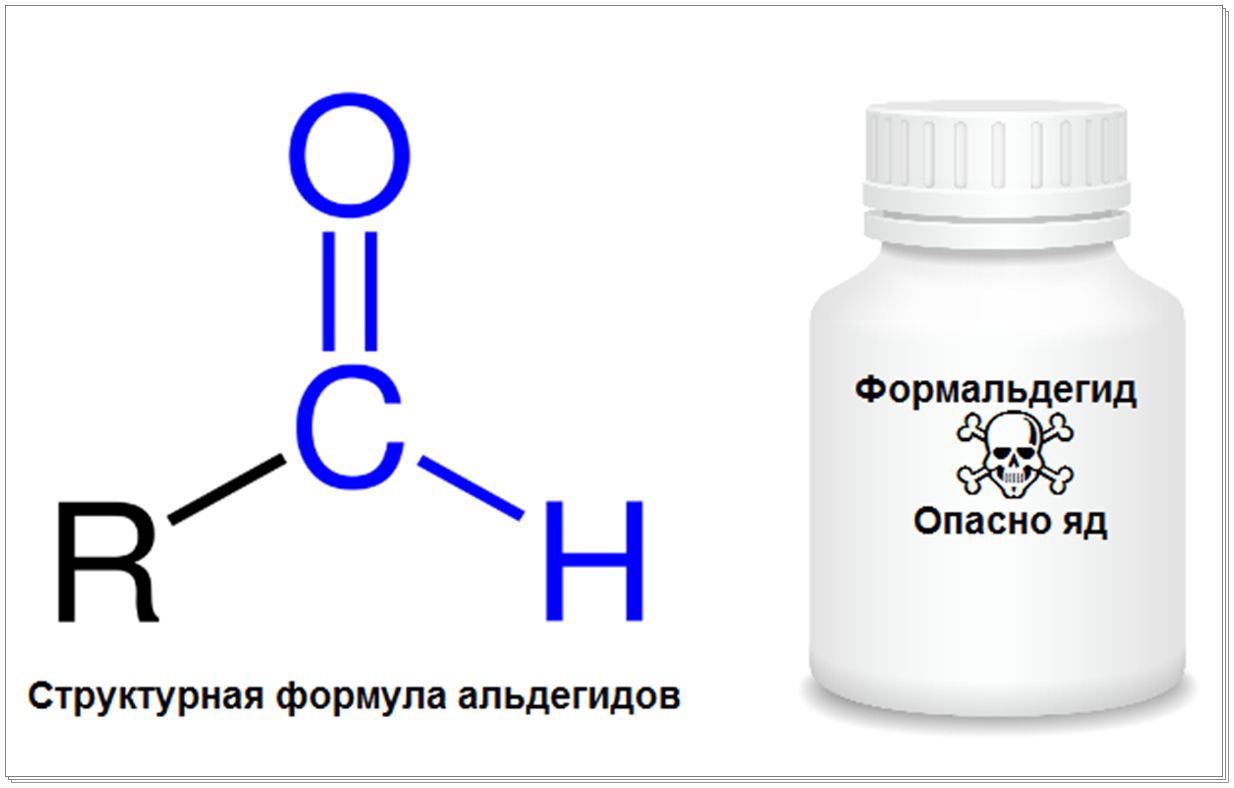
Альдегиды представляют собой класс органических соединений, в которых содержится альдегидная группа (-CHO).
В них карбонильная группа связана с одним атомом водорода и одной группой R.
Альдегиды могут быть представлены в виде вещества R-CHO.
Они носят название «альдегиды» по аналогии с латинским термином «alcohol dehydrogenatus», что можно перевести как «спирт, лишенный водорода».
Альдегиды: структура, получение и примеры
Функциональной группой альдегидов является одновалентная группа С—ОН.
Примерами альдегидов могут служить формальдегид СН2О и ацетальдегид C2H4O:
Альдегиды получаются при окислении соответствующих спиртов.
Например, муравьиный альдегид образуется при прохождении смеси паров метилового спирта и воздуха над нагретым катализатором:
Получение альдегидов
Метанол (и другие спирты) реагируют с обычными неорганическими окислителями, например бихроматом калия К2Сr2О7, при этом образуются соответствующие альдегиды.
При реакции кислого водного раствора бихромата калия с метанолом раствор изменяет цвет от светло-оранжевого до грязно-зеленого вследствие образования иона Сr3+, окрашенного в зеленый цвет.
У раствора появляется характерный запах, по которому легко идентифицировать присутствие формальдегида СН2О.
Этой формуле соответствует структура, HCHO или СН2О. Следует отметить, что между углеродом и кислородом существует двойная связь и что все атомы расположены в одной плоскости.
Суммарная реакция образования формальдегида следующая.
ЗСН3ОН + Сr2O27— (водн) + 8Н+ (водн) → ЗСН2О + 2Сr3+ (водн) + 7Н2О (8)
Бихромат-ион в левой части уравнения восстанавливается в ионы хрома Сr3+ в правой части, так что в ходе реакции должно происходить окисление метанола в формальдегид.
Для того чтобы яснее показать, что метанол окисляется, уравняем эту реакцию методом составления уравнений окисления — восстановления:
Сr2О27— (водн) + 14Н+ (водн) + 6е → 2Сr3+ (водн) + 7Н2О
Для того чтобы уравнять реакцию окисления метанола в формальдегид, запишем сначала, что:
CH3OH → СН2O
Это не означает, что атомы водорода теряются в реакции, как можно было бы предположить по недостатку двух атомов водорода в правой части. несоответствие устраняется добавлением двух ионов водорода:
СН3ОН → СН2О + 2Н+(водн)
Тетерь остаются не уравненными заряды. Добавление двух электронов в правую часть уравнения завершит процесс уравнивания, и реакция будет выглядеть так:
СН3ОН → СН2О + 2Н+ (водн) + 2е
Это уравнение показывает, что молекула метанола теряет в реакции электроны, т. е. окисляется.
Формальдегид — второй представитель в ряду окисления метана.
Точно так же этанол можно окислить бихромат-ионом в соединение, называемое ацетальдегидом, СН3СНО.
Ацетальдегид образуется из формальдегида в результате замены одного атома водорода СН3-группой.
Полное уравнение реакции, приводящей к образованию ацетальдегида из этанола, можно записать так:
ЗСН3СН2ОН + С2O27—(водн) + 8Н+(водн) → ЗСН3СНО + 2Сr3+(водн) +4 7Н2О
Муравьиный альдегид
Называемый также формальдегидом, — газ с резким, неприятным запахом, хорошо растворимый в воде.
Он обладает превосходными антисептическими, а также дубящими свойствами.
40%-ный водный раствор муравьиного альдегида, называемый формалином, широко применяется для дезинфекции, консервирования анатомических препаратов, протравливания семян перед посевом и т. п.
Значительные количества муравьиного альдегида используются для получения продуктов его взаимодействия с фенолом.
Происходящую реакцию можно изобразить следующей схемой:
Процесс образования больших молекул из молекул с меньшим молекулярным весом, протекающий с отщеплением (или перемещением) атомов и атомных групп, называется конденсацией.
Продуктом конденсации фенола с формальдегидом являются так называемые феноло-формальдегидные смолы, обладающие замечательным свойством.
При нагревании они вначале размягчаются, а при дальнейшем нагревании (особенно в присутствии соответствующих катализаторов) затвердевают.
Эти смолы смешивают с различными наполнителями (древесной мукой, измельченной бумагой, асбестом, графитом и т. п.), с пластификаторами, красителями и из полученной массы изготовляют методом горячего прессования различные изделия.
В последние годы феноло-формальдегидные смолы нашли новые области применения — для производства строительных деталей из отходов древесины, в литейном деле для изготовления оболочковых форм и др.
Уксусный альдегид
СН3СНО (темп. кип. 21°) получается в промышленности путем присоединения воды к ацетилену в присутствии солей ртути, являющихся катализаторами данной реакции.
Эта реакция, имеющая большое промышленное значение, была открыта русским ученым Михаилом Григорьевичем Кучеровым (1850—1311).
Альдегиды очень легко окисляются, превращаясь при этом в карбоновые кислоты.
Так, например, при окислении уксусного альдегида получается уксусная кислота, имеющая большое народнохозяйственное значение.
Вследствие легкой окисляемости альдегиды являются энергичными восстановителями.
Быстрые ответы?
Это органические вещества (спирты) у которых с помощью химической реакции отняли водород, примером может служит формальдегид полученный из метанола:
СН3ОН → СН2О + 2Н+(водн)
Это класс соединений, к которому, в том числе, относится и формальдегид, и уксусный альдегид, и даже цитрусовый.
Название альдегид происходит от alcohol dehydrogenatum, то есть дегидрированный спирт.
Для получения пластмасс, лекарственных препаратов, для синтеза органических веществ, а также в парфюмерии и т.д.


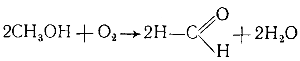

Добавить комментарий
Для отправки комментария вам необходимо авторизоваться.