Химическая связь у фторидах иллюстрирует сложную природу взаимодействия электронов между атомами.
Этот процесс образует прочную и стабильную молекулу например фторид лития LiF, демонстрируя важность условий и свойств отдельных элементов.
Несмотря на то, что электроны объединены в общую пару, их распределение неравномерное, что приводит к важным энергетическим различиям между атомами лития и фтора.
Сильное притяжение, которое атом фтора осуществляет к электронам, подчеркивает ионный характер связи, где один из атомов фактически передает электрон другому.
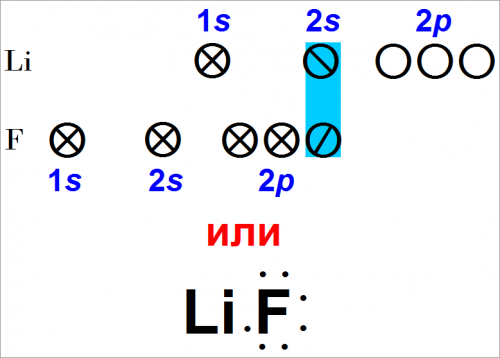
Химическая связь в газообразном фтористом литии
Поскольку ни один из атомов фтора не может отдать полностью электрон другому атому, связь возникает за счет образования обобщенной пары электронов, расположенной около обоих ядер.
Литий имеет один валентный электрон, который, следовательно, может быть обобщен с одним электроном атома фтора:
Таким образом, можно ожидать, что образуется устойчивая молекула LiF. Термин «устойчивая» означает, что для разрушения молекулы требуется затрата энергии.
Образование химической связи у фторидов уменьшает энергию системы, так как связывающая пара электронов притягивается одновременно как ядром атома лития, так и ядром атома фтора.
Нельзя сказать, что электроны обобщены равномерно. В конце концов атомы лития и фтора притягивают электроны с разной силой.
Это видно по энергиям ионизации этих двух атомов:
F(г) → F—(г) + е(г)
∆Н = 401,5 ккал/моль (48)
Li(г) → Li+(г) + е(г)
∆Н = 124,3 ккал/моль (49)
что атом фтора удерживает электроны гораздо сильнее, чем атом лития.
Поэтому обобщенная пара электронов во фтористом литии атомом фтора притягивается сильнее, чем атомом лития.
Энергия системы уменьшается при смещении электронов к атому фтора.
Если электроны, образующие связь, расположены ближе к одному из двух атомов, то говорят, что связь имеет ионный характер.
В предельном случае электроны, образующие связь, настолько приближаются к одному из атомов, что этот атом фактически приобретает электронную конфигурацию отрицательного иона.
Таким примером является газообразный LiF.
Мы можем представить его электронную формулу:
или
Li+F— (51)
Когда молекуле можно приписать формулу (50) или (51), говорят, что в этой молекуле имеется ионная связь.
Отличие ковалентной связи от ионной
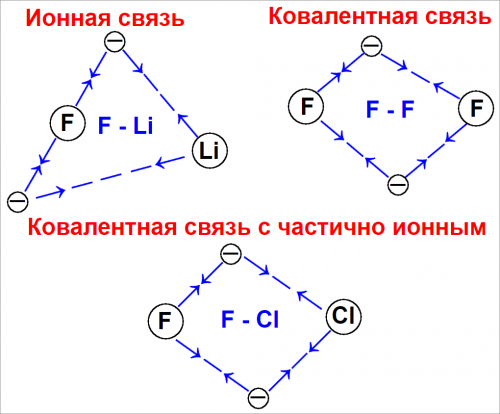
Атомы в молекуле фтора удерживаются друг около друга за счет энергии, освобождающейся в результате нахождения пары электронов одновременно около обоих ядер атомов фтора.
Электроны в молекуле перемещаются таким образом, что они приблизительно равномерно распределены вокруг равноценных ядер атомов фтора.
Такое симметричное распределение вполне обоснованно, так как оба ядра атомов фтора притягивают электроны связи с равной силой.
Атомы в молекуле фтористого лития также удерживаться друг около друга за счет энергии, которая освобождается при нахождении пары электронов одновременно вблизи ядер атомов лития и фтора.
Однако в этом случае электроны движутся так, что все время находятся ближе к атому фтора, чем к атому лития.
Фтор притягивает эти электроны связи сильнее, чем литий.
Рис. (3). Распределение электронов при различных типах связей.
Существует лишь единственное условие, при котором между двумя атомами возникает химическая связь: образование всех, химических связей обусловлено одновременным присутствием электронов около обоих ядер.
Термин ковалентная связь означает, что наиболее энергетически устойчивой конфигурацией является симметричное расположение электронов между двумя атомами.
Когда же электроны, образующие связь, расположены несколько ближе к одному из атомов, то говорят, что связь имеет ионный характер.
Термин ионная связь означает, что электроны смещены к одному из атомов настолько, что атомы с достаточной точностью можно представить в виде пары ионов, расположенных близко друг к другу.
На рис. (3) схематически показано распределение электронов при образовании ковалентной, частично ионной и ионной связей.
Здесь показано также, как были бы расположены электроны на моментальном снимке.
В каждом типе связи притяжение между электронами и ядрами определяет энергетическую устойчивость молекулы.
Дипольный характер ионной связи
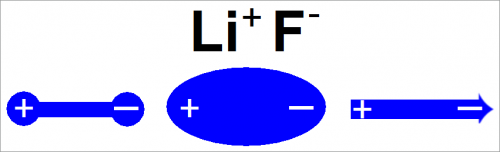
Рис. 4. Изображение электрического диполя в молекуле газообразного фтористого лития.
Смещение пары электронов к одному из атомов в ионной связи приводит к разделению зарядов в молекуле. Это можно представить грубо так, как изображено на рис. 4.
Молекула имеет положительный заряд на литии и отрицательный на фторе, т. е. она обладает электрическим дипольным моментом.
Такая молекула называется полярной молекулой.
Силы взаимодействия полярных молекул гораздо чем силы взаимодействия неполярных молекул.
Последнее изображение на рис. 4 применяется наиболее часто; это самый простой способ изображения полярной связи.
Стрелка означает, что отрицательный заряд сосредоточен на одном конце связи.
Направление стрелки показывает, что сила, с которой эта молекула может действовать на другую молекулу, зависит от направления подхода второй молекулы.
Ионный характер связей элементов с фтором
Можно ожидать, что только что описанные эффекты будут проявляться при образовании химических связей между фтором и другими элементами.
Энергия ионизации элементов помогает нам понять механизм электрон-адерного притяжения.
В таблице 1 сравниваются значения энергии ионизации элементов второго периода и фтора. В последней колонке таблицы указывается тип химической связи.
Изменение характера связей, о котором можно судить по данным таблице 1, оказывает большое влияние на изменение свойств соединений фтора.
Характер связей изменяется вследствие увеличения разности между энергиями ионизации двух связанных в молекулу атомов.
Ионный характер связей элементов с водородом
В главе 6 водород был охарактеризован как особая группа, состоящая только из одного элемента. Химия водорода во многом отличается от химии других элементов.
Мы убедились, что это действительно так, когда попытались предсказать ионный характер связей с водородом.
Энергия ионизации атома водорода, равная 313,6 ккал/моль, очень близка к энергии ионизации фтора, так что можно ожидать образования ковалентной связи между этими атомами в молекуле HF.
В действительности же эта молекула обладает значительным дипольным моментом, что указывает на ионный характер связи.
То же справедливо для связи О—Н 434 в воде и в меньшей степени для связи N—Н в аммиаке. Ионный характер связей с водородом нельзя предсказать по его энергии ионизации.
Изучение свойств большого числа соединений, содержащих водород, показывает, что ионный характер связей с водородом приблизительно такой, как если бы водород имел энергию ионизации около 200 ккал/моль.
Таким образом, связь фтора с водородом в HF — ионная, и химики считают, что электроны смещены к атому фтора, а на атоме водорода создается частичный положительный заряд.
Водород ведет себя как элемент с более низкой энергией ионизации, чем у фтора, но в меньшей степени, при образовании связей водорода с кислородом и азотом.
Углерод-водородная связь имеет лишь слабый ионный характер.
На другом конце периодической таблицы элементов, как известно, газообразный гидрид лития имеет значительный дипольный момент, но этот диполь направлен в другую сторону.
В LiH электроны смещены к атому водорода, а на атоме лития создается частичный положительный заряд.
Это согласуется с низкой энергией ионизации лития, равной 124,3 ккал/моль, т. е. меньше значения 200 ккал/моль, принятого для водорода.
Для наших целей достаточно рассматривать образование связей с водородом, принимая кажущееся значение энергии ионизации водорода равным приблизительно 200 ккал/моль.
Таблица типы связей в некоторых соединениях фтора
| Соединение | Связь | Энергия ионизации ккал/моль | Тип связи | |
| Элемент связанный с F | Фтор | |||
| FF | F-F | F 401,5 | 401,5 | Ковалентная |
| OF2 | О-F | О 313,8 | 401,5 |
Ионная усиливается, Ковалентная уменьшается. Ионная уменьшается Ковалентная усиливается |
| NF3 | N-F | N 335,0 | 401,5 | |
| CF4 | C-F | С 259,5 | 401,5 | |
| BF3 | B-F | В 191,2 | 401,5 | |
| BeF2 | Be—F | Be 214,9 | 401,5 | |
| LiF | Li—F | Li 124,3 | 401,5 | Ионная |
Энергия связей и электрические диполи
Экспериментально найдено, что связь между двумя атомами с различными энергиями ионизации обычно гораздо прочнее, чем связь между молекулами с близкими энергиями ионизации.
Поскольку электрические диполи образуются вследствие разности между энергиями ионизации связанных в молекулу атомов, можно сделать вывод, что в молекулах, обедающих дипольными моментами, следует ожидать наличия прочных связей.
Сопоставьте, например, энергии связей молекул Na2, Сl2 и NaCl в газовой фазе:
Na2(г) → 2Na(г) ∆HNa2 = 17ккал
Cl2(г) → 2CI(г) ∆HCl2 = 57ккал
NaCI(г) → Na(г) + Cl(г) ∆HNaCl = ?
Приблизительно энергию связи NaCl можно установить по энергиям связей Na2 и Сl2, равным 17 и 57 ккал.
Энергия связи Na2 17 ккал обеспечивается обобщением пары электронов двумя атомами натрия, поэтому следует ожидать, что один атом натрия в NaCl «поставляет» для энергии связи половину этого количества: 17 : 2 = 8,5 ккал.
Точно так же один атом хлора в NaCl «поставляет» половину энергии для образования связи Сl2 : 57 : 2 = 28,5 ккал.
Можно вычислить ∆HNaCl:
∆HNaCl = (∆HNa2 + HCl2)/2 = 8,5 + 28,5 = 37,0
Экспериментально мы установили, что величина ∆HNaCl гораздо больше — она равна 98 ккал, расхождение составляет 98 — 37 = 61 ккал.
Это расхождение объясняется большой разностью между энергиями ионизации атомов натрия и хлора:
Сl(г) → Сl+(г) + е Е1 = 300 ккал
Na(г) → Na+(г) + е E1 = 118 ккал
Разность в 61 ккал/моль указывает на то, что при образовании связи энергия уменьшается больше, чем на 37 ккал, так как пара электронов распределена неравномерно между двумя атомами в NaCl.
Электроны располагаются ближе к атому, который удерживает их более прочно (атом хлора).
В таблице приведены некоторые данные, на основании которых можно установить зависимость между разностью энергий ионизации E1(Х) — E1(Y) и энергиями связей ∆HXY — 1/2 (∆HX2 + ∆HY2).
Таблица разности энергий ионизации и энергий свази
| X | Y | Молекула XY | Е1(X) — E1(Y) | ∆HXY — 1/2 (∆HX2 + ∆HY2) |
| Na | K | NaK (г) | 18 | 0 |
| Cl | Br | ClBr (г) | 27 | 1 |
| Cl | Li | LiCl (г) | 176 | 58 |
| Cl | Na | NaCl (г) | 182 | 61 |
| Cl | К | KCl (r) | 200 | 66,5 |
| F | Li | LiF (г) | 277 | 106 |
Излишне говорить, что, если ионный характер влияет на энергетическую устойчивость химической связи, он влияет также и на химические свойства этой связи.
Стремление к достижению состояния с минимальной энергией — один из факторов, которые определяют, какие химические превращения будут происходить.
Чем прочнее связь, тем большее количество энергии требуется для разрушения этой связи и образования другого соединения.
Следовательно, мы убедились, что ионные связи более устойчивы, чем ковалентные, и что ионный характер связи влияет на ее химические свойства.