Теория Бора объяснила расположение электронов в атомах и их влияние на свойства элементов.
Схемы строения атомов всех химических элементов основаны на опыте изучения спектров и периодическом законе, но это гипотезы, а не окончательные истины.
Число электронов равно порядковому номеру элемента, и первоначально считалось, что электроны движутся по круговым орбитам.
Теперь электроны группируются по слоям: K, L, M, N, где K — ближайший к ядру слой.
Максимальное число электронов в слое описывается формулой N = 2n².
У наружного слоя, лишенные электронов атомы становятся положительно заряженными и образуют ионы.
Строение электронных оболочек атомов
Теория Бора позволила разрешить очень важный вопрос о расположении электронов в атомах различных элементов и установить зависимость свойств элементов от строения электронных оболочек их атомов.
В настоящее время разработаны схемы строения атомов всех химических элементов.
При построении этих схем ученые исходили из богатейшего опытного материала, накопленного при изучении оптических и рентгеновых спектров.
А также из общих соображений об устойчивости различных комбинаций электронов.
Но основной путеводной нитью служил им периодический закон.
Нужно, однако, иметь в виду, что все эти схемы отнюдь не являются чем-то законченным, твердо установленным.
Они представляют собой лишь более или менее достоверную гипотезу, позволяющую объяснить многие физические и химические свойства элементов.
Мы уже видели, что число электронов, вращающихся вокруг ядра атома, равно порядковому номеру элемента в периодической системе.
Первоначально предполагалось, что электроны движутся группами по одним и тем же круговым орбитам, образующим несколько концентрических колец.
Впоследствии пришлось допустить, что каждый электрон имеет свою орбиту, которая может быть кругом или эллипсом.
И что все эти орбиты различно расположены в пространстве, т. е. наклонены друг к другу под разными углами, окружая ядро со всех сторон.
Расположение электронов по кольцам заменено теперь их группировкой по электронным слоям.
Каждому слою принадлежит определенно заполняющее или как бы насыщающее его число» электронов.
Электроны одного слоя
Электроны одного и того же слоя характеризуются почти одинаковым запасом энергии, т. е. находятся примерно на одинаковом энергетическом уровне.
Вся электронная оболочка атома распадается на несколько слоев, или энергетических уровней, обозначаемых буквами К, L, М, N..
Буквой К обозначают ближайший к ядру слой.
Электроны каждого следующего слоя находятся на более высоком энергетическом уровне, чем электроны предыдущего «слоя.
Орбиты всех электронов, относящихся к одному слою, обладают одинаковой величиной больших осей эллипса, но различной величиной малых осей.
Наибольшее число электронов N,могущих находиться в данном слое (на данном энергетическом уровне), равно удвоенному квадрату номера слоя:
N = 2n2
где n — номер слоя.
Таким образом, первый ближайший к ядру слой К может содержать не больше двух электронов, второй слой L — небольше восьми, третий слой М — не больше восемнадцати и т. д.
Кроме того, установлено, что число электронов в наружном слое для всех элементов, кроме палладия, не превышает восьми, а в предпоследнем слое — восемнадцати.
Электроны наружного слоя
Электроны наружного слоя, как наиболее удаленные от ядра и следовательно, наименее прочно связанные с ядром.
Могут отрываться от атома и присоединяться к другим атомам, входя в состав наружного слоя последних.
Атомы, лишившиеся одного или нескольких электронов, становятся заряженными положительно, так как заряд ядра атома превышает сумму зарядов оставшихся электронов.
Наоборот, атомы, присоединившие к себе лишние электроны, заряжаются отрицательно.
Образующиеся таким путем заряженные частицы,качественно отличные от соответствующих атомов, называются ионами.
Величина заряда иона зависит от числа потерянных или приобретенных атомом электронов.
Например, если атом алюминия,имеющий в своей оболочке всего 13 электронов, потеряет три электрона наружного слоя.
То образовавшийся ион алюминия будет иметь заряд +3, так как от потери электронов заряд ядра, равный +13, не изменится.
А общий заряд, оставшихся электронов станет равным —10 (заряд иона будет —10 +13 = +3).
Атом серы имеет всего 16 электронов, из которых шесть находятся в наружном слое.
Если он присоединит к себе еще два электрона, то получится отрицательный двухзарядный ион серы.
Так как общий заряд электронов станет равным —18, а заряд ядра + 16 (заряд иона будет —18 + 16 = —2).
Ионы принято обозначать теми же символами, что и атомы, добавляя к ним справа вверху столько знаков плюс или минус,скольким единицам равняется заряд иона.
Например, положительный трехзарядный ион алюминия обозначается символом Al+++ или Аl3+, отрицательный двухзарядный ион серы — символом S— или S2- и т. д.
Электронейтральные атомы
Многие ионы в свою очередь могут терять или присоединять электроны, превращаясь при этом или в электронейтральные атомы,или в новые ионы с другим зарядом.
При потере электронов положительный заряд иона увеличивается, а отрицательный уменьшается или становится равным нулю(т. е. ион превращается в электронейтральный атом).
Наоборот, присоединение электронов к иону уменьшает его положительный заряд и увеличивает отрицательный.
Например, положительный двухзарядный ион железа Fe++, отдавая один электрон, становится трехзарядным ионом Fe+++.
А присоединяя два электрона, —превращается в электронейтральный атом Fe; отрицательный двухзарядный ион серы S—, отдавая два электрона, превращается в атом серы S и т. д.
Переход наружных электронов от одних атомов к другим совершается при самых разнообразных химических процессах, о чем мы подробно будем говорить в следующей главе.
От числа этих электронов и зависит, главным образом, различие в химических свойствах атомов.
Только электроны наружного слоя принимают участие в выделении и поглощении лучей видимого света и близких к ним по длине волны инфракрасных и ультрафиолетовых лучей.
Электроны в атомах отдельных элементов
Посмотрим теперь, как расположены электроны в атомах отдельных элементов.
Рис. 2. Схема строения атома гелия
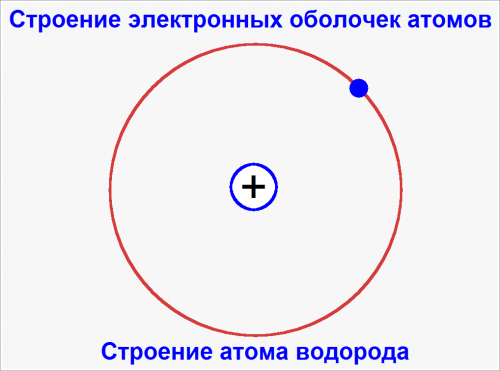
В атоме водорода имеется только один электрон, который и вращается вокруг ядра по кругу, как изображено на рис..
Атом водорода легко может отдавать свой электрон другим атомам, превращаясь в положительный однозарядный ион водорода, состоящий только из ядра, которое получило название протон.
Следующий за водородом элемент гелий имеет два электрона, образующих первый слой K.
Оба электрона вращаются по круговым орбитам, наклоненным друг к другу под некоторым углом (рис. 2).
И характеризуются одинаковым запасом энергии, т. е. находятся на одном и том же энергетическом уровне (первом).
Такое расположение электронов очень устойчиво, вследствие чего гелий совершенно не склонен ни отдавать свои электроны, ни присоединять к себе электроны других атомов.
Этим и объясняется химическая инертность гелия. После гелия идет литий с тремя электронами.
Электронный слой гелия, как очень устойчивый, остается и здесь.
Третий же электрон располагается на значительно вытянутой эллиптической орбите, начиная собой построение второго электронного слоя (рис. 3).
Этот электрон связав с ядром слабее двух первых, и атом лития легко отдает его, превращаясь в положительно заряженный ион.
Рис. 3. Схема строения атома лития.
Следующие после лития элементы бериллий, бор, углерод и т. д. сохраняют гелиевый слой из двух электронов, но число электронов в их втором слое L последовательно увеличивается на единицу, пока не достигнет восьми в атоме неона.
Тогда получается очень устойчивое, симметричное расположение электронов, вследствие чего неон, подобно гелию, не может ни отдавать, ни присоединять электроны.
В атомах же элементов, расположенных между гелием и неоном, электроны L-слоя связаны непрочно.
И у первых членов ряда могут отщепляться, что-приводит к превращению этих атомов в ионы.
Рис. 4. Схема строения атома натрия.
Вслед за неоном идет натрий. Десять его электронов расположены так же, как в атоме неона (два на первом энергетическое Уровне и восемь на втором).
А одиннадцатый электрон занимает сильно вытянутую эллиптическую орбиту и находится уже на третьем энергетическом уровне (рис. 4).
Атом натрия имеет, таким образом,структуру, подобную атому лития, что делает понятным химическое сходство этих элементов.
При переходе от натрия к магнию, алюминию и следующим за ним элементам, так же как и при переходе от лития к неону, происходит последовательное увеличение числа электронов.
Но уже в третьем слое, и у аргона опять получается устойчивая структура с восьми электронным третьим слоем.
Представленные на рисунках 21—26 атомные модели,отображающие расположение электронных орбит в атомах различных элементов, очень громоздки и неудобны.
Для химических целей совершенно достаточными являются упрощенные схемы строения атомов, изображенные на рис. 27.
Нужно только иметь в виду, что эти схемы отнюдь не дают представления о действительном расположении электронов в атомах.
А лишь указывают число электронов в слоях: каждая окружность соответствует одному слою электронов, т. е. одному энергетическому уровню.




Добавить комментарий
Для отправки комментария вам необходимо авторизоваться.