Полярность химических связей при разделении зарядов в молекуле
Слабые вандерваальсовы силы, вызывают конденсацию паров, состоящих из молекул с ковалентными связями.
Образование ионной решетки является результатом более сильного взаимодействия между молекулами с ионными связями.
Но молекулы большинства веществ представляют собой нечто среднее между двумя этими предельными случаями.
Очень часто атомы в молекулах удерживаются друг около друга с помощью связей, которые в основном ковалентные, но у которых имеется достаточное разделение зарядов для того, чтобы влиять на свойства молекул.
Такие молекулы называются полярными молекулами.
Пример полярной молекулы хлороформ СНСl3.
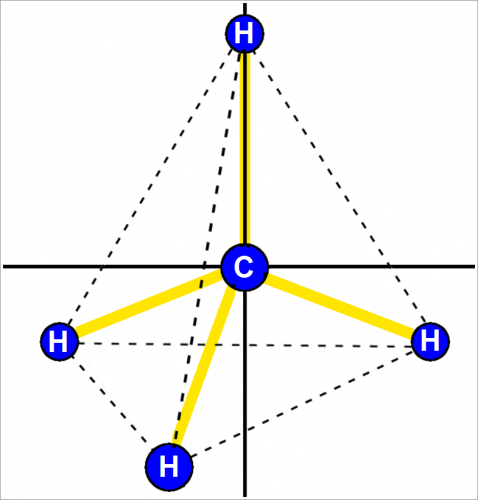
Углы между связями у него такие же, как у метана СН4 и четыреххлористого углерода ССl4.
Углерод с sр3-связью образует четыре направленные к вершинам тетраэдра связи.
Результирующий электрический диполь четырех связей С—Сl в ССl4 отсутствует, он появляется при замене одного из атомов хлора атомом водорода.
В такой молекуле появляется молекулярный диполь. Наличие электрических диполей очень важно, так как они влияют на химические свойства веществ, построенных из таких молекул.
Диполь
Силы, действующие меж молекулами, в большой степени зависят от наличия молекулярных диполей.
Две молекулы, которые имеют молекулярные диполи, притягиваются друг к другу сильнее, чем молекулы без диполей.
Одним из наиболее важных результатов такого притяжения является способность оказывать растворяющее действие.
В таблице приведены данные о растворимости некоторых веществ в двух растворителях — четыреххлористом углероде ССl4 и ацетоне СН3СОСН3.
Эти два растворителя отличаются по полярности. В ССl4 центральный атом углерода окружен четырьмя связями, образующими правильный тетраэдр, как изображено на рис. 1.
При такой форме молекулы ССl4 не имеют молекулярного диполя. В отличие от ССl4 молекула ацетона менее симметрична и атом кислорода сообщает молекуле существенный электрический диполь.
Зависимость растворимости от диполей
Сопоставьте растворимости, приведенные в таблице. Первые два вещества — метан СН4 и этан С2Н6 — не имеют молекулярных диполей.
В каждом случае растворимость в ССl4 превышает растворимость в СН3СОСН3.
Следующие два вещества — хлорметан СН3Сl и диметиловый эфир СН3ОСН3 — имеют молекулярные диполи, отличающиеся от нуля.
Для каждого из этих веществ растворимость в ацетоне больше растворимости в четыреххлористом углероде.
При растворении вещества его молекулы должны быть отделены друг друга и затем окружены молекулами растворителя.
Кроме того, молекулы растворителя должны «выталкиваться», чтобы освободить место для молекул растворяемого вещества.
Поскольку при взаимодействии диполей выделяется большое количество энергии, энергетически более выгодно, если полярные молекулы СН3Сl окружены тоже полярными молекулами растворителя.
Поэтому СН3Сl лучше растворяется в полярном растворителе ацетоне, чем в неполярном четыреххлористом углероде.
С другой стороны, такие неполярные молекулы, как СН4, с трудом могут (вклиниваться), между сильно взаимодействующими между собой молекулами растворителя ацетона.
Это сделать им значительно труднее, чем равномерно распределиться при растворении между молекулами неполярного растворителя. Поэтому СН4 лучше растворяется в неполярном растворителе ССl4.
Растворимость электролитов вводе
Растворение электролитов в воде — одно из самых важных проявлений свойств растворителя, которые объясняются наличием в его молекулах электрических диполей.
Кристаллический хлористый натрий — очень устойчивое соединение, о чем свидетельствует его высокая температура плавления, но он легко растворяется в воде.
Для того чтобы разрушить прочную кристаллическую решетку, необходимо сильное взаимодействие между молекулами воды и ионами, которые образуются в растворе.
Такое взаимодействие можно объяснить полярными свойствами воды.
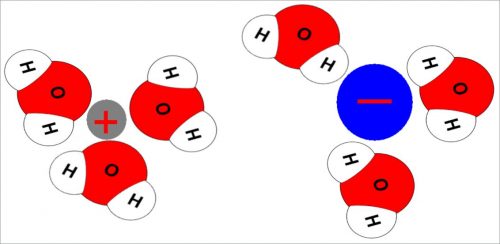
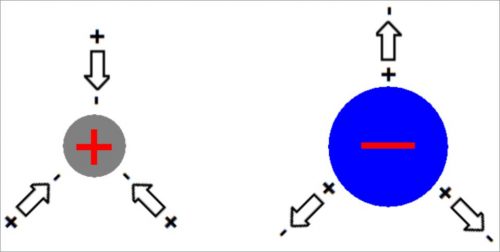
Если около иона находится электрический диполь, то энергия системы будет минимальной, когда диполь ориентирован так, что к иону с определенным знаком заряда подходит противоположно заряженный конец диполя.
Молекулы воды имеют тенденцию ориентироваться вокруг иона:
- Положительный конец диполя воды направлен к иону, если ион заряжен отрицательно.
- Наоборот, от иона, если он заряжен положительно.
Таблица растворимости органических соединений в четыреххлористом углероде ССl4 и ацетоне СН3СОСН, при 25°С
| Растворяемое вещество | Полярность растворяемого вещества | Растворимость, моль/л | |
| CCl4 (неполярный растворитель) | СН3СОСН3 (полярный растворитель) | ||
| Метан СН4 | Неполярный | 0,029 | 0,025 |
| Этан C2H6 | > | 0,22 | 0,13 |
| Хлорметан CH3Cl | Полярный | 1,7 | 2,8 |
| Диметиловый эфир СН3ОСН3 | » | 1.9 | 2,2 |
На рис. 3 этот процесс, называемый гидратацией, изображен схематически.
Гидратация ионов
Ориентация диполей воды вокруг ионов оказывает двойное влияние. Во-первых, поскольку противоположные заряды размещаются друг возле друга, энергия системы уменьшается.
Это облегчает отрыв ионов от кристалла хлористого натрия и переход их в раствор.
Кроме того, ориентация молекул вокруг ионов — «закрепление» их около ионов — способствует упорядоченному расположению частиц в растворе.
А так как любая система стремится к максимальной неупорядоченности, ориентация препятствует отрыву молекул от кристалла и переходу их в раствор.
Эти два следствия гидратации ионов:
- Понижение энергии при растворении электролита
- Одновременное уменьшение неупорядоченности (т е. упорядоченное расположение молекул воды) — и придают воде отличительные свойства растворителя ионных веществ.
Так эти рассуждения помогают объяснить, почему при растворении в воде одних солей (например NH4Cl) тепло поглощается, а других веществ (например, NaOH) — выделяется.
По отношению к большинству растворителей кристалл имеет более низкую энергию, чем раствор, поэтому при растворении такого вещества тепло поглощается.
Однако в воде в результате гидратации ионов энергия системы уменьшается, и в процессе растворения возможно выделение тепла.