Никель (Niccolum)
Ат. вес 58,71. Подобно кобальту, никель встречается в природе преимущественно в виде соединений с мышьяком или серой; таковы, например, минералы купферникель NiAs, мышьяковоникелевый блеск NiAsS и др. Никель более распространен, чем кобальт (0,02% от веса земной коры). Наиболее крупные месторождения никеля находятся в Канаде. На втором месте стоит Советский Союз, располагающий богатыми месторождениями никеля на Урале, в Казахстане, на Таймырском и Кольском полуостровах.
Уральские месторождения никеля были известны еще задолго до революции, но царская Россия не имела никелевой промышленности и ввозила никель из-за границы. Эта отрасль промышленности была создана у нас только при советской власти. Первый никелевый завод начал работать на Урале в 1934 г.
Мировая добыча никеля (без СНГ) составила в 1956 г. более 200 тыс. т.
Металлический никель имеет желтовато-белый цвет, очень тверд, хорошо полируется, притягивается магнитом. Уд. вес его 8,9, темп. пл. 1453°. Никель не окисляется на воздухе и легко растворяется только в азотной кислоте. Нормальный потенциал никеля равняется —0,23 вольта.
Никель имеет ряд важных практических применений. Никель расходуется в небольших количествах для покрытия других металлов (никелирование). Главная же масса никеля идет на производство различных сплавов с железом, медью, цинком и другими металлами. Присадка никеля к стали повышает ее вязкость и механическую прочность, придает стали большую жароустойчивость и сопротивляемость коррозии. Стали, содержащие никель и другие металлы, например хромоникелевая сталь, в состав которой входит 1—4% никеля и 0,5—2% хрома, широко применяются для производства артиллерийских орудий, всевозможной брони, бронебойных снарядов, оболочек для пуль и т. п.
Сплавы никеля с медью, содержащие большое количество никеля, практически не подвергаются коррозии и широко используются в химической промышленности, судостроении и самолетостроении. Сплавы с меньшим содержанием никеля применяются для чеканки монет (никелевая бронза).
Из других сплавов никеля, имеющих важное практическое значение, отметим следующие: 1) инвар — сталь с содержанием 35—37% никеля, отличающаяся чрезвычайно малым коэффициентом расширения: из нее изготовляют стержни для часовых маятников, шкалы для разных измерительных приборов; 2) платинит — сталь, содержащая 0,15 % углерода и 44 % никеля; она имеет такой же коэффициент расширения, как стекло, поэтому ее можно впаивать в стекло; применяется при изготовлении электрических лампочек; 3) нихром — сплав никеля с хромом, обладающий большим электрическим сопротивлением; применяется для изготовления реостатов и различных нагревательных приборов; 4) никелин—сплав меди, никеля и цинка, также отличающийся довольно значительным сопротивлением, мало изменяющимся при повышении температуры.
Мелко раздробленный никель является очень важным катализатором, широко применяемым % при многих химических процессах. Из чистого никеля изготовляют лабораторную посуду.
Соединения никеля очень сходны с соединениями кобальта. Как и кобальт, никель образует два основных окисла: закись никеля NiO и окись никеля Ni203 и соответствующие им гидроокиси, но только один ряд солей, в которых никель двухвалентен.
Гидрат закиси никеля Ni(OH)2 выпадает в виде светлозеле-ного осадка при действии щелочей на растворы солей двухвалентного никеля. При нагревании он теряет воду и переходит в серо-зеленую закись никеля NiO.
Соли никеля большей частью имеют зеленый цвет и при растворении дают зеленые растворы. Наиболее употребительной из них является сернокислый никель NiSО4 • 7Н2О или никелевый купорос, образующий красивые изумрудно зеленые кристаллы. Гидрат окиси никеля Ni(OH)3 имеет черно-бурый цвет и образуется при действии на гидрат закиси никеля сильных окислителей. По свойствам он подобен гидрату окиси кобальта Со(ОН)3.
Никель образует много комплексных солей, но в отличие от кобальта он в этих солях всегда двухвалентен.
С окисью углерода никель дает жидкое летучее соединение тетракарбонил никеля Ni(CO)4, разлагающееся при нагревании с выделением никеля. На образовании Ni(CO)4 основан один из способов извлечения никеля из никелевых руд.
Из соединений никеля важное практическое значение имеет окись никеля, применяемая при изготовлении щелочных железо-никелевых или кадмиево-никелевых аккумуляторов.
В железо-никелевом аккумуляторе одна из пластин состоит из спрессованного порошка железа, другая — из водной окиси никеля, к которой для лучшей проводимости добавлены никелевые опилки. Электролитом служит 30%-ный раствор едкого кали.
Действие железо-никелевого аккумулятора аналогично действию свинцового аккумулятора: железо играет роль свинца, а окись никеля — роль двуокиси свинца. При разряде атомы железа теряют каждый по два электрона, превращаясь в ионы Fe++, которые связываются с гидроксильными ионами и образуют Fe(OH)2. Отдаваемые железом электроны переходят по внешней цепи к окиси никеля, где восстанавливают Ni2O3 с образованием Ni(OH)2.
Отрицательный электрод Положительный электрод
Fe — 2е— + 2OН’ = Fe(OH)2 Ni2O3 + 2е—+ 3Н2O = 2Ni(OH)2 + 2OH
Сложив эти два уравнения, получим общее уравнение происходящей при разряде аккумулятора реакции:
Fe + Ni2O3 + 3H2O = Fe(OH)2 + 2Ni(OH)2
При зарядке аккумулятора эта же реакция протекает в обратном направлении: у катода Fe(OH)2, присоединяя электроны, превращается в металлическое железо, а у анода Ni(OH)2 отдает электроны и снова образуется Ni2O3. Поэтому оба процесса — зарядка и разряд аккумулятора — могут быть выражены одним уравнением зарядка
Электродвижущая сила железо-никелевого аккумулятора равна 1,4 вольта. Хотя он меньшей электродвижущей силой, чем свинцовый аккумулятор, но зато выгодно отличается от последнего меньшим весом, простотой в обращении и более продолжительным сроком службы.
Вы читаете, статья на тему Никель (Niccolum)

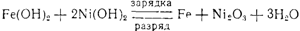
Добавить комментарий
Для отправки комментария вам необходимо авторизоваться.