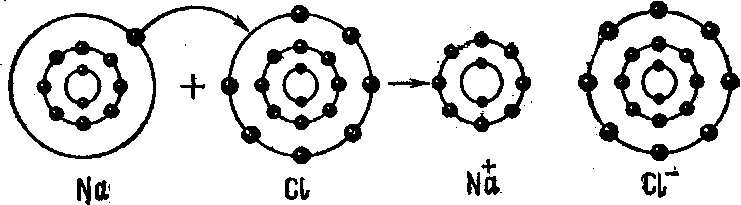
Ионные твердые вещества можно рассматривать как ряды положительных и отрицательных ионов.
Упакованных так, что каждый положительный ион окружен только отрицательными соседними ионами, а каждый отрицательный ион — только положительными ионами.
На рис. показано такое расположение ионов в кристалле хлористого натрия.
Устойчивость ионных кристаллов
Наличие электрического диполя в молекуле газообразного фтористого лития LiF было объяснено различием в энергиях ионизации атомов лития и фтора.
Молекула построена за счет электронов связи, находящихся одновременно около обоих ядер, энергетически выгодно, чтобы около атома фтора электронная плотность была выше, чем у атома лития.
Образуется устойчивая полярная молекула. Устойчивая, но в газообразном состоянии весьма реакционно способная.
Валентные орбиты атома лития почти свободны.
По имеющимся экспериментальным данным (например, для СН2, BF3, атомов углерода, атомов металла) наличие свободных валентных орбит означает, что в таком случае сохраняется дополнительная способность к образованию связи.
Следовательно, молекулы фтористого лития более устойчивы, когда они построены так, что каждый атом лития расположен одновременно около нескольких атомов фтора.
Так же как и в металлах, атом со свободными орбитами более устойчив, если он окружен несколькими соседними атомами.
Тогда электроны, удерживаемые соседними атомами, могут находиться одновременно около двух или более ядер.
Но в данном случае имеется существенное отличие от металлов — в твердом фтористом литии половина атомов обладает высокой энергией ионизации.
Атомы фтора прочно удерживают свои электроны.
Поэтому в ионных кристаллах характерная для металлов подвижность электронов отсутствует.
Это означает, что у ионных кристаллов нельзя ожидать проявления металлических свойств. Посмотрим, какие же свойства имеют эти вещества.
Свойства ионных кристаллов
Ионные вещества, например фтористый литий и хлористый натрий, образуют кристаллы правильной формы с четкими гранями.
Чистые кристаллы таких ионных твердых веществ обычно прозрачны и бесцветны, но они могут быть окрашены очень небольшими добавками примесей.
Например нитрит натрия NaNO2 загрязненный нитратом натрия NaNO3 образует желтоватые кристаллы.
Такое же действие оказывают и дефекты, имеющиеся в кристаллической решетке. Большинство ионных кристаллов имеет высокие температуры плавления.
Электропроводность расплавленных фтористого лития и хлористого натрия можно легко измерить.
Она ниже, чем у металлов, на несколько порядков.
Расплавленный хлористый натрий при 750° С имеет электропроводность, составляющую лишь 10-5 электропроводности металлической меди при комнатной температуре.
Маловероятно, что электрический зарядов расплавленном NaCl перемещается по тому же механизму, что и в металлической меди.
Опыты показывают, что заряд в расплавленном NaCl переносится ионами Na+ и Сl—.
Электропроводность расплава — одно из наиболее характерных свойств веществ с ионными связями.
Напротив, молекулярные кристаллы обычно плавятся с образованием молекулярных жидкостей, которые не проводят электрический ток в заметной степени.
Вывод
Ионные кристаллы, такие как фтористый литий и хлористый натрий, представляют собой структуры, отличающиеся прочными и однородными связями между положительными и отрицательными ионами.
Их устойчивость обусловлена высокими энергиями ионизации компонентов, что предопределяет их стабильность в твердом состоянии, но в то же время ограничивает подвижность электронов, характерную для металлов.
Эти вещества обладают особыми физическими свойствами, включая кристаллическую решетку с четкими гранями и высокими температурами плавления.
Хотя они и проявляют некоторую электропроводность в расплавленном состоянии, это свойство значительно уступает проводимости металлов, что подчеркивает различие в механизме переноса заряда.