Кристаллическая структура твёрдых веществ характеризуется организованным расположением его элементов.
В зависимости от состава и химической связи между ними существует четыре типа кристаллических решёток:
- Молекулярная.
- Атомная.
- Ионная.
- Металлическая.
Некоторые вещества могут существовать как в кристаллическом, так и в аморфном состоянии.
Что такое кристаллическое строение твердых тел
Твердые тела по сравнению с газами и жидкостями характеризуются наименьшим расстоянием между частицами и наиболее значительными молекулярными силами как притяжения, так и отталкивания.
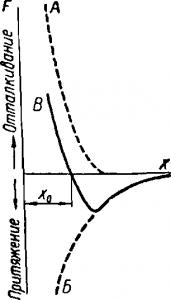
Величина этих сил зависит от расстояния х между частицами:
- При уменьшении расстояния силы возрастают.
- При увеличении — быстро убывают.
При этом в обоих случаях силы отталкивания с изменением расстояния изменяются в большей степени, чем силы притяжения (рис. 2, кривая А — силы отталкивания, кривая Б — силы притяжения).
Если для данного тела произвести сложение сил отталкивания и притяжения (т. е. для каждого значения расстояния х произвести алгебраическое сложение ординат этих кривых), то получится результирующая кривая В.
Из которой видно, что при некотором расстоянии х0 между молекулами силы отталкивания и притяжения уравновешивают друг друга; на этом расстоянии в среднем и находятся молекулы в веществе.
Молекулярные силы имеют упругий характер.
Поэтому частицы в твердых телах совершают колебания около точек своего среднего положения.
Колебания происходят во всех направлениях и имеют беспорядочный характер, свойственный молекулярному движению.
Молекулярные силы обусловлены взаимодействием имеющихся в атомах электрических зарядов.
Однако во многих случаях это взаимодействие имеет более сложный характер, чем кулоновские силы, действующие между свободными зарядами.
Кристаллическое строение
Совокупность точек, определяющих расположение частиц (атомов, ионов, молекул) в общей структуре вещества, называется пространственной (или кристаллической) решеткой.
В зависимости от природы вещества-решетки разделяются на атомные, ионные, металлические и молекулярные.
Простые вещества имеют атомную решетку.
Молекулярные силы в них образуются в результате обмена электронами и образования между атомами общих электронных оболочек.
Два электрона от разных атомов с противоположно направленными спинами спариваются на одной орбите и связывают ядра этих атомов силой притяжения.
Между атомами образуется обменная или ковалентная связь, отличающаяся высокой прочностью.
Ковалентная связь атомов характерна для органических веществ, хотя часто встречается и у неорганических.
Последние отличаются твердостью, высокой температурой плавления и малой растворимостью.
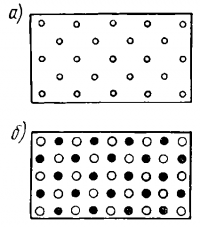
На рис. 3 показаны условные плоскостные схемы различных пространственных решеток. Схема атомной решетки — рис. 3, а.
В веществах с ионным строением каждый ион связан с окружающими его ионами противоположного знака силами электростатического притяжения.
Пример — рис. 1 кристалл поваренной соли с кубической пространственной решеткой.
Условная плоскостная схема ионной решетки — рис. 3, б. Вещества с ионным строением тверды, хрупки, имеют высокую температуру плавления и хорошо растворимы в воде.
Пространственная решетка в металлах
В металлах пространственная решетка состоит из атомов, потерявших: наиболее слабо связанные с ядром внешние электроны, т. е. из ионов.
Оторвавшиеся электроны называют свободными электронами.
В процессе теплового движения они беспорядочно перемещаются по всей массе металла и, взаимодействуя с ионами, создают силы, связывающие эти ионы в одну общую массу вещества.
Наличие в металлах свободных электронов обусловливает их высокую теплопроводность и электропроводность. Плоскостная схема металлической решетки — рис. 3, е.
Связь между ними образуется так называемыми силами Ван-дер-Ваальса, которые возникают как силы притяжения между электрическими диполями (рис. 4).
Эти диполи могут быть постоянными, как, например, у молекул, полярных от природы, они могут индуцироваться вследствие поляризации молекул при их взаимном сближении.
И наконец, можно считать, что мгновенные диполи, непрерывно меняющие свою величину и направление, образуются в процессе движения электронов вокруг ядер атомов.
Силы отталкивания между атомами или молекулами связывают с взаимным отталкиванием электронных оболочек атомов при сближении их на достаточно малое расстояние.
Связь через силы Ван-дер-Ваальса является наиболее универсальной в природе и встречается не только у твердых тел и жидкостей органической или неорганической природы, но и у газов.
Твердые вещества с молекулярным строением мягкие, с низкой температурой плавления, большей частью хорошо растворимые.
Плоскостная схема молекулярной решетки с двухатомными молекулами — рис. 3, е.
Решетка кристаллов в реальных условиях
В реальных условиях пространственная решетка кристаллов часто имеет те или иные нарушения, проявляющиеся в виде местного беспорядочного расположения атомов или молекул.
А также включения, например, в атомную или молекулярную решетку ионов того же вещества или даже атомов и молекул посторонних веществ.
Упорядоченное расположение атомов или молекул может обусловливать некоторое отличие физических свойств вещества по различным направлениям.
Это свойство кристаллических тел называется анизотропией.
Анизотропия проявляется, например, в том, что механическая прочность вещества в различных направлениях неодинакова и при раздроблении кристалл раскалывается на мелкие части, которые сохраняют такую же геометрическую форму.
По различным направлениям могут различаться также теплопроводность, электропроводность, оптические свойства и т. д.
Монокристаллом называется кристаллическое тело, которое имеет одну общую пространственную решетку. Таковы, например кристаллы кварца, алмаза, квасцов и др.
Тела, состоящие из мелких кристаллов различной величины, расположенных в беспорядке, и не всегда сохраняющих свою правильную форму, называются поликристаллическими.
Большинство тел имеют поли кристаллическую структуру. Вследствие беспорядочного расположения мелких кристаллов анизотропия у поликристаллических тел не проявляется.
Существует также аморфное состояние твердых тел, которое характеризуется беспорядочным расположением частиц вещества. Аморфное строение имеют, например, стекло, смолы и др. Физические свойства аморфных тел не зависят от направления.
Такие вещества называются изотропными.
Быстрые ответы?
Кристаллы характеризуются пространственной периодичностью в расположении равновесных положений атомов, которая достигается наличием дальнего порядка и носит название кристаллической решётки.
Твёрдые тела, в которых частицы (атомы и молекулы) расположены регулярно, образуя трёхмерно-периодическую пространственную укладку — кристаллическую решётку.
Наиболее изученные структурные типы меди, магния, α-железа, алмаза (простые вещества), хлорида натрия, сфалерита, вюрцита, хлорида цезия, флюорита (бинарные соединения), перовскита, шпинели (тройные соединения).


Добавить комментарий
Для отправки комментария вам необходимо авторизоваться.