Как изменяются свойства элементов при радиоактивных превращениях в зависимости от выбрасываемых ими частиц. Здесь наблюдается очень простая закономерность, известная под названием закона смещения.
Элемент, образовавшийся из другого элемента при испускании α-лучей, по своим химическим свойствам занимает в периодической системе место на две группы:
- Влево от исходного элемента.
- А элемент, образующийся при β-излучении, смещается на одну группу вправо от исходного элемента.
Что такое закон смещения
Закон смещения непосредственно вытекает из теории атомного распада, если допустить, что не только α-частицы, но и β-частицы выбрасываются из ядра.
С потерей α-частицы заряд ядра уменьшается на две единицы, а следовательно, и порядковый номер уменьшается на два.
Вследствие чего элемент передвигается в периодической системе на две клетки влево (например, радий стоит во второй группе, а образующийся из него радон— в нулевой группе).
Наоборот, выделение β-частиц увеличивает заряд ядра на единицу, и элемент передвигается на одну клетку вправо.
Объяснение закона смещения
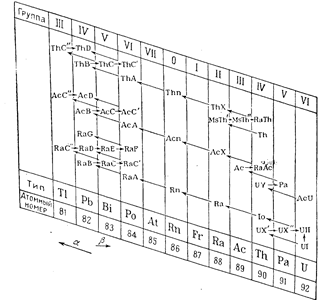
Наглядной иллюстрацией закона смещения может служить табличка, изображенная на рис., в которой показано последовательное смещение радиоактивных элементов, образующихся при распаде урана, тория и актиния, из группы в группу периодической системы.
Теория атомного распада не только определяет положение продуктов распада в периодической системе, но и дает возможность вычислять их атомные веса.
В самом деле, при выбрасывании из ядра α-частицы масса ядра, а стало быть, и атомный вес уменьшаются на четыре единицы, тогда как выбрасывание β-частиц ввиду их ничтожной массы практически не изменяет массу всего атома.
Таким образом, атомный вес элемента, образовавшегося при α-излучении, на четыре единицы меньше, чем исходного элемента.
Атомный же вес элемента, получающегося при β-излучении, практически остается таким же, как и атомный вес исходного элемента.
Если атом потеряет две β-частицы, а затем одну α-частицу, то заряд ядра (а следовательно, и все свойства элемента) не изменится, но атомный вес уменьшится на четыре единицы и таким образом, получится изотоп первого элемента.
Так, например, из RaD (№ 82) согласно схеме, приведенной на рис., получается изотопный с ним RaG или свинец (№ 82).
Установление понятия изотопии позволило, как мы уже об этом упоминали, включить все радиоактивные элементы в периодическую систему.
Плеяды радиоактивных элементов
Радиоактивные изотопы составляют 10 плеяд, расположенных в двух последних рядах таблицы Менделеева.
Распределение плеяд по группам периодической системы показано в табличке на рис. Семь плеяд состоят исключительно из радиоактивных элементов, в трех остальных имеется по одному нерадиоактивному элементу.
Типичными элементами плеяд, считаются элементы с наибольшей продолжительностью жизни или устойчивые элементы, указанные внизу таблички.
Все члены плеяды имеют один и тот же заряд ядра и одинаковые химические свойства, отличаясь друг от друга только атомным весом и радиоактивностью.
Наибольшее число элементов (изотопов) содержат плеяды свинца и полония.
Вы читаете, статья на тему Закон смещения

Добавить комментарий
Для отправки комментария вам необходимо авторизоваться.