Теория:
Валентность и степень окисления титана (Ti) — это способность элемента в зависимости от условий проявлять переменные химические связи и приобретать соответствующий условный заряд.
Это переходный металл из IV группы, который наглядно демонстрирует, как переменная валентность титана приводит к разнообразным степеням окисления.
Поэтому в соединениях проявляет переменную валентность II, III, IV (2, 3, 4) и следовательно степень окисления +2, +3, +4.
Зависимость степени окисления от валентности титана
Для большинства соединений титана существует прямая зависимость: численное значение степени окисления совпадает со значением валентности.
Валентность (2, 3, 4) создает структурную основу — она определяет, сколько связей титан может образовать.
Степень окисления (+2, +3, +4) реализует эту возможность в виде условного заряда.
Поскольку Титан отдает электроны, его СО всегда положительна и численно равна его валентности в данном соединении.
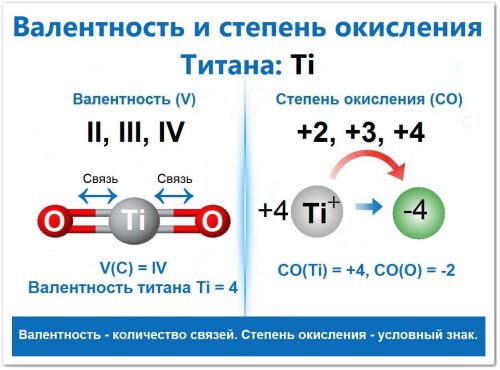
Валентность (V) титана: 2, 3, 4
Валентность титана (то есть, число химических связей, которые он может образовать) является переменной и может быть 2, 3 или 4.
Это обусловлено тем, что атом титана имеет четыре внешних электрона и может использовать для связей разное их количество:
Валентность 2 (Два): Используются только два внешних электрона.
Пример: в оксиде титана (II) — TiO.
Валентность 3 (Три) : Используются три внешних электрона. Пример: в оксиде титана(III) — Ti2O.
Валентность 4 (Четыре): Это самая устойчивая и распространенная валентность, где используются все четыре внешних электрона.
Пример: в диоксиде титана — TiO2.
Степень окисления (СО) Титана: +2, +3, +4
Степень окисления титана (условный заряд) тесно связана с его валентностью и в соединениях всегда положительна, поскольку титан является металлом, который отдает электроны.
СО = +2: Менее устойчивое состояние. Например, в TiO.
СО = +3: Устойчивое состояние, характерное для многих солей Титана, например, TiCl3.
СО = +4: Наиболее устойчивое и распространенное состояние в природе. Пример: TiO2.
Валентность и степень окисления на примере диоксида титана (TiO2)
Диоксид титана (TiO2) — это наиболее стабильное соединение титана, которое наглядно демонстрирует связь между его валентностью и степенью окисления.
➡️ Валентность (V)
Валентность — это способность атома образовывать химические связи (в условной схеме O = Ti = O это число палочек).
В TiO2 титан проявляет свою максимальную способность к связыванию — валентность IV (четыре), а кислород всегда имеет валентность II (две).
➡️ Степень окисления (СО)
Степень окисления — это условный заряд, который атомы приобретают в результате обмена электронами.
Кислород, как более электроотрицательный элемент, имеет СО = -2.
Чтобы уравновесить общий отрицательный заряд двух атомов кислорода (2 х -2 = -4), титан должен отдать четыре электрона.
Следовательно, его степень окисления СО = +4.
Пример решения, задача:
▶️ Дано:
Соединение TiCl4 (хлорид титана (IV).
⌕ Найти:
Определите валентность (V) и степень окисления (СО) в соединении.
✨ Решение:
Определение СО: Хлор (Cl) имеет СО = -1.
СО (Ti) + 4 х (-1) = 0
СО (Ti) = +4
Валентность (V): Титан связан с четырьмя атомами хлора.
V (Ti) = IV
✅ Ответ:
Его валентность равна IV, степень окисления +4.
Ключевые моменты химии титана:
Часто задаваемые вопросы:
Как переходный металл, проявляет переменную валентность II, III и IV.
Соответствующие им степени окисления — +2, +3 и +4.
Наиболее стабильным состоянием является степень окисления +4 (валентность IV).
Валентность (II, III, IV) — это количество химических связей, которые может образовать.
Степень окисления (+2, +3, +4) — это условный заряд атома, который он приобретает в соединении.

Добавить комментарий
Для отправки комментария вам необходимо авторизоваться.