Теория:
Сиборгий (Sg) занимает положение в 7‑м периоде, что определяет его уникальную и сложную природу. Элемент назван в честь Гленна Сиборга, выдающегося американского физика.
Будучи гомологом (аналогом) вольфрама, из‑за релятивистских эффектов он проявляет свойства, характерные для тяжёлых металлов 6‑й группы, оставаясь при этом крайне нестабильным сверхтяжёлым объектом.
Его 6‑я группа (в рамках периодической системы элементов) или по старому стилю (VI B) задают его ключевые параметры: валентность VI (наиболее устойчивая) и степени окисления от +2 до +6.
Химические качества подтверждаются его электронной структурой (конфигурацией):
[Rn] 5f14 6d4 7s2.
На этой формуле наглядно можно определить его статус как массивного представителя семейства d‑металлов.
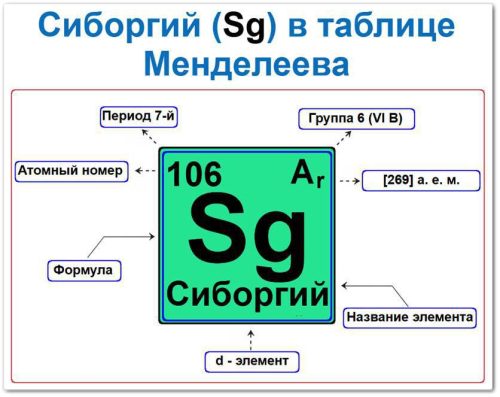
Сиборгий (Sg) — это d‑элемент 6‑й группы 7‑го периода таблицы Менделеева.
Эти координаты в классификации элементов определяют, какая будет химическая активность и реакционная способность атома в условиях лабораторных экспериментов.
Как определить положение Сиборгия в Таблице Менделеева
Место сиборгия в структуре менделеевской таблицы задаётся характеристиками его трансуранового ядра — его «химическим паспортом»:
- Порядковое число (атомный номер).
- Название и буквенный символ.
- Группа (вертикальный ряд).
- Период (горизонтальный уровень).
- Электронное семейство (сиборгий — d‑элемент).
Порядковый номер / атомный номер (Z = 106)
- Однозначно выделяет элемент в ряду сверхтяжёлых техногенных гигантов.
- В ядре — 106 протонов; в нейтральной оболочке — 106 электронов.
- Распределение электронов: [Rn] 5f14 6d4 7s2.
Важно: наличие 6 валентных электронов (6d4 7s2) роднит его с хромом, молибденом и вольфрамом, но эффекты высокой скорости электронов (релятивизм) вносят свои правки в его поведение.
Название и символ
- Наименование: «сиборгий» (в честь Гленна Сиборга).
- Символ: Sg.
Примечание: это был первый случай в истории, когда элемент назвали в честь ещё живого на тот момент учёного.
Группа (6 / VI B)
Расположен в 6‑й группе; в прежней номенклатуре — побочная подгруппа VI группы (подгруппа хрома).
Что дает элементу:
- 6 валентных электронов.
- Валентность: высшая валентность равна VI, что подтверждено получением оксихлорида сиборгия.
- Степень окисления: теоретический диапазон широк, но наиболее стабильной является +6.
- Типичные состояния: +6 (доминирующее), +5, +4.
Важно: по своим свойствам сиборгий очень близок к вольфраму, образуя схожие летучие соединения с галогенами.
Период (7‑й)
Находится в последнем завершённом ряду — электроны распределены по семи энергетическим слоям.
Что дает элементу:
- Огромный заряд ядра и сильное сжатие внутренних орбит.
- Релятивистская химия: из-за огромной массы ядра 7s-орбиталь «проседает» ближе к центру, что делает сиборгий чуть менее склонным отдавать электроны, чем ожидалось бы от простого аналога вольфрама.
Относительная атомная масса (Ar)
- Ar(Sg) ≈ [269] а.е.м. (для наиболее стабильного изотопа 269Sg).
- Значение: суммарная масса нуклонов искусственно созданного ядра.
Уникальность: время жизни изотопов сиборгия исчисляется секундами и миллисекундами, что делает его изучение настоящим научным подвигом.
Все значения для всех элементов можно узнать в таблице атомных масс.
d‑Элемент (электронный блок)
Застраивающимся является d-подуровнь шестого слоя (6d4).
Что дает элементу:
- Типичные свойства переходного металла: способность образовывать комплексные соединения и разнообразие степеней окисления.
Определение энергетических уровней Сиборгия по Таблице Менделеева
Положение Сиборгия (Sg) в системе Менделеева — это готовый «паспорт» его внутреннего устройства.
Находясь в начале ряда тяжелых переходных металлов, он открывает путь к пониманию структуры своих соседей — Бория и Хассия.
1. 7-й период (Количество этажей)
Сиборгий находится в седьмой строке таблицы. По фундаментальному закону химии: номер периода всегда равен количеству электронных слоев. Итог: у Сиборгия 7 энергетических уровней.
2. Список «жильцов» (Распределение электронов)
Атомный номер Сиборгия — 106. Его 106 электронов распределены по уровням следующим образом: ☢️ )2 )8 )18 )32 )32 )12 )2
Для сравнения: у соседа слева, Дубния (105), на предпоследнем уровне 11 электронов, а у Сиборгия (106) — 12. Это последовательное заполнение d‑подуровня делает его полноценным участником большой семьи переходных металлов.
3. 6-я группа (Химический характер)
Сиборгий стоит в одной колонке (группе) с Хромом, Молибденом и Вольфрамом.
- d‑элемент: его химическая природа определяется заполняющимся 6d‑подуровнем.
- Место в блоке: он является «тяжелым братом» вольфрама, что определяет его тугоплавкость и химическую стойкость.
Проверка знаний: Как определить Сиборгий по таблице Менделеева
Отметьте три правильных утверждения, которые однозначно описывают Сиборгий (Sg) в периодической системе элементов.
Показать верные ответы и пояснения
Правильные ответы: 1, 2, 3
- 1) 106 протонов. Это уникальный атомный номер сиборгия.
- 2) 6-я группа и гомолог вольфрама. Сиборгий химически подобен вольфраму и молибдену.
- 3) Формула 6d47s2. Это стандартная конфигурация внешних слоев для 106-го элемента.
- 4) Использование в быту. Ошибка: сиборгий радиоактивен и живет считанные секунды. В лампах используют вольфрам.
- 5) Один период с Железом. Ошибка: Железо в 4-м периоде, Сиборгий — в 7-м.
Часто задаваемые вопросы:
Сиборгий (Sg) — это искусственно синтезированный радиоактивный металл, первый элемент, названный в честь живого человека.
Номер: 106. Группа: 6. Период: 7. Блок: d-блок.
Металл, химически похожий на вольфрам. Самый стабильный изотоп живет около 3 минут (Sg-269).

Добавить комментарий
Для отправки комментария вам необходимо авторизоваться.