Теория:
Хассий (Hs) занимает положение в 7‑м периоде, что определяет его уникальную (исключительную) природу среди трансурановых элементов.
Будучи гомологом (аналогом) осмия, из‑за релятивистских эффектов он сохраняет свойства тяжёлого металла, но проявляет необычную летучесть в форме высшего оксида (HsO4).
А его 8‑я группа (ранее — побочная подгруппа VIII группы) задаёт его ключевые параметры: валентность VIII (наиболее характерная для высших соединений), а также возможные степени окисления от +2 до +8.
Структура атома подтверждается его электронной формулой (конфигурацией):
[Rn] 5f14 6d6 7s2.
На которой наглядно можно определить его положение как самого тяжёлого представителя подгруппы железа (семейства платиноидов 7-го периода).
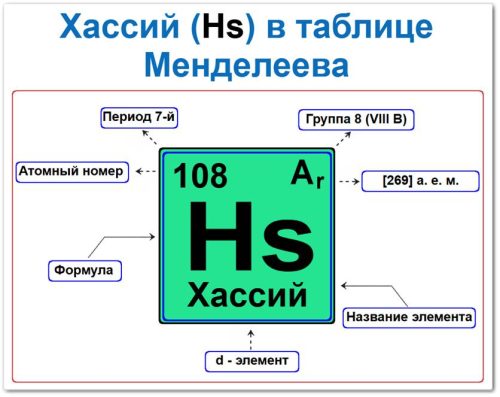
Хассий в таблице Менделеева можно определить на основании закона периодичности: положение в группе и перевода, а также порядкового номера / атомный номер (Z = 108)
Как определить положение Хассия в Таблице Менделеева
Локация хассия в таблице описывается характеристиками радиоактивного супертяжёлого ядра — его «химическим аттестатом» (паспортом):
- Порядковый номер (атомный номер).
- Наименование (название) элемента.
- Группа (вертикальный ряд).
- Период (горизонтальный ряд/строка).
- Электронное семейство (хассий — d‑элемент).
Порядковый номер / атомный номер (Z = 108)
- Служит уникальным кодом элемента в ряду искусственно синтезированных ядер.
- В ядре — 108 протонов; в нейтральной оболочке — 108 электронов.
- Электронное строение: [Rn] 5f14 6d6 7s2.
Важно: Наличие d-электронов роднит его с осмием и рутением, что позволяет ему образовывать летучий тетраоксид HsO4, аналогичный OsO4.
Название и символ
- Название: «хассий» (в честь немецкой земли Гессен — Hassia на латыни).
- Символ: Hs.
- Примечание: имя элемента увековечивает место его первого синтеза — Дармштадт (Германия).
Группа (8 / VIII B)
Расположен в 8‑й группе; по классической классификации — побочная подгруппа VIII группы.
Химический потенциал:
- Наличие 8 валентных электронов (учитывая d-подуровень).
- Валентность: высшая валентность VIII, что крайне редко для сверхтяжёлых ядер.
- Степень окисления: диапазон возможных значений широк, но наиболее стабильны в экспериментах +8 и +4.
Важно: Хассий — первый элемент за пределами группы актиноидов, для которого экспериментально доказано существование степени окисления +8.
Период (7‑й)
Находится в 7‑м (заключительном) периоде — его электроны распределены по семи энергетическим уровням.
Влияние на свойства:
- Релятивистское сжатие: из-за огромного заряда ядра (108+) электроны на 7s-орбиталях движутся со скоростями, близкими к световым, что делает атом компактнее.
- Металлический характер: Несмотря на летучесть оксидов, сам хассий является плотным переходным металлом (в теории — одним из самых плотных).
Относительная атомная масса (Ar)
- Ar(Hs) ≈ [269] а.е.м. (для изотопа 269Hs).
- Определение: масса самого долгоживущего нуклида, полученного в ускорителе.
- Стабильность: Хассий находится на подступах к «острову стабильности». Период полураспада его изотопов составляет секунды (для 270Hs — до 22 секунд), что позволяет изучать его химию «на лету».
Все значения для всех элементов можно узнать в таблице атомных масс.
d‑Элемент (электронное семейство)
Застраивающимся является d‑подуровень (6d6).
Специфика блока: Это типичный переходный элемент, чьи свойства определяются электронами d-оболочки, что делает его химически активнее, чем p-элементы конца периода.
Определение энергетических уровней Хассия по Таблице Менделеева
Положение Хассия (Hs) в системе Менделеева — это готовый «паспорт» его внутреннего устройства.
Находясь рядом с Мейтнерием и Дармштадтием, он демонстрирует строгую логику заполнения электронных оболочек.
1. 7-й период (Количество этажей)
Хассий находится в седьмой строке таблицы. По фундаментальному закону химии: номер периода всегда равен количеству электронных слоев.
- Итог: У Хассия 7 энергетических уровней.
2. Список «жильцов» (Распределение электронов)
Атомный номер Хассия — 108. Его 108 электронов распределены по уровням следующим образом:
☢️ )2 )8 )18 )32 )32 )14 )2
Для сравнения: У соседа слева, Бория (107), на предпоследнем уровне 13 электронов, а у Хассия (108) — 14.
Это постепенное заполнение d-подуровня и определяет его уникальные свойства.
3. 8-я группа (Химический характер)
Хассий стоит в одной колонке (группе) с Железом, Рутением и Осмием.
- d-элемент: Его химическая природа определяется заполняющимся 6d-подуровнем.
- Место в блоке: Он является «тяжелым братом» осмия, что делает его частью группы платиноидов.
Что это дает элементу (Свойства):
Экстремальные степени окисления: Хассий способен проявлять степень окисления +8, образуя тетроксид (HsO4). Это роднит его с осмием и подтверждает его место в 8-й группе.
Статус «Тяжелого аналога Осмия»: Теоретически Хассий — один из самых плотных металлов на Земле. Его плотность могла бы достигать рекордных 41 г/см3 (для сравнения, золото — 19.3 г/см3).
Релятивистский эффект: Заряд ядра в 108 протонов настолько велик, что электроны на 7s-орбитали движутся с огромной скоростью и «прижимаются» ближе к ядру.
Это делает Хассий более стабильным химически, чем можно было ожидать.
Проверка знаний: Как определить Хассий по таблице Менделеева
Выберите три верных тезиса, которые однозначно характеризуют Хассий (Hs) в структуре таблицы.
По каким маркерам можно безошибочно узнать элемент №108?
Показать верные ответы и пояснения
Правильные ответы: 1, 2, 3
- 1) Заряд ядра +108. Это фундаментальный идентификатор Хассия.
- 2) 8-я группа и 7-й период. Точные координаты в периодической системе.
- 3) Аналог Осмиевой группы. Хассий повторяет химию осмия, образуя похожие оксиды.
- 4) Легкий газ. Ошибка: Хассий — сверхтяжёлый металл.
- 5) Состав сахара. Ошибка: сахар состоит из C, H и O. Хассий — искусственный элемент.
- 6) Известен алхимикам. Ошибка: Впервые получен в 1984 году в Германии.
Вывод
На основе «химического аттестата» элемента №108 можно выделить три ключевые особенности:
- Структурная мощь (7-й период):
Нахождение в финальном периоде определяет наличие 7 энергетических уровней.
Его электронная схема
)2 )8 )18 )32 )32 )14 )2отражает статус одного из самых тяжелых ядер, когда-либо изученных человеком. - Химическое родство с Осмием (8-я группа):
Являясь d-элементом и гомологом осмия, Хассий подтверждает свою принадлежность к группе уникальной способностью проявлять высшую степень окисления +8.
Это позволяет ему образовывать летучий тетраоксид (HsO4), что экспериментально доказывает строгое соблюдение периодического закона даже для сверхтяжелых трансактинидов.
- Релятивистский статус «Сверхплотного металла»:
Огромный заряд ядра (108+) вызывает релятивистское сжатие 7s-орбиталей, делая атом компактнее.
В теории это делает Хассий экстремально плотным металлом (до 41 г/см3), превращая его в «тяжелого короля» платиноидов и один из самых плотных материалов в известной Вселенной.
Часто задаваемые вопросы:
Расположен в 8-й группе (побочная подгруппа VIII группы) и в 7-м периоде. Он находится прямо под Осмием (Os), являясь его тяжелым химическим аналогом.
Поскольку находится в 7-м периоде, у него 7 энергетических уровней. Его электронная схема: 2, 8, 18, 32, 32, 14, 2.
Относительная атомная масса Хассия составляет приблизительно [270] а.е.м. (для самого стабильного изотопа 270 Hs).
Значение всегда пишется в скобках, так как элемент получен искусственно.

Добавить комментарий
Для отправки комментария вам необходимо авторизоваться.