На рубеже XVIII и XIX веков, когда для исследования свойств веществ стали применять электрический ток, было обращено внимание на то, что одни вещества в водном растворе проводят электрический ток, а другие его не проводят.
В дальнейшем Фарадей назвал вещества, водные растворы которых проводят электрический ток, электролитами.
К их числу были отнесены щелочи, кислоты, соли, так была выдвинута теория о электролитической диссоциации.
Объяснение теории электролитической диссоциации
Вещества, растворы которых не проводили электрический ток, были названы неэлектролитами (сахар, спирт, бензол и другие органические вещества).
В настоящее время, когда стали известны типы химической связи, оказалось возможным объяснить такое различие в поведении веществ.
Явление электропроводности веществ в водных растворах зависит от типа химической связи в молекулах как растворенного вещества, так и растворителя.
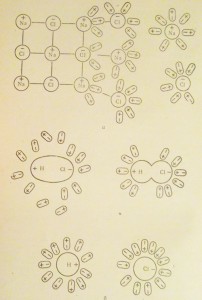
Молекула воды, как мы уже говорили, представляет собой диполь.
Если в воде растворить вещество, молекула которого имеет ионный тип связи и потому кристаллическая решетка его тоже ионная.
Диполи воды ориентируются к положительным ионам своими отрицательными полюсами, а к отрицательным ионам — положительными полюсами (рис.16.а).
Между ионами и диполями воды нарастают силы электростатического притяжения и возникают своеобразные связи.
Которые, в конце концов, расчленяют ионную кристаллическую решетку на отдельные ионы, окруженные диполями воды, поэтому их называют гидротированными ионами.
Примерно то же происходит, если в воде растворяют вещество с полярными молекулами, например хлористый водород (см. рис. 16,б).
Вместе с тем, если молекулы растворенного вещества построены по ковалентному неполярному типу связи, то никаких ионов в растворе не образуется, так как неполярные молекулы не испытывают со стороны молекул воды такого воздействия, как молекулы ионные и полярные.
В основном по ковалентному неполярному типу построены молекулы большинства органических веществ.
Поэтому органические вещества, как правило, не являются электролитами.
Рис. 16. Схема диссоциации хлорида натрия в воде (а) и диссоциация полярных молекул HCl в воде (б)
Таким образом, электролитами могут быть только такие вещества, молекула которых построена по ионному, или полярному, типу связи атомов в молекуле.
Помимо этого, молекулы растворителя также должны иметь полярное строен и е. Только при таких условиях можно ожидать распада молекул на ионы.
Распад молекул электролита на ионы под действием растворителя называется электролитической диссоциацией.
Слово «диссоциация» означает «обратимый распад».
Если раствор электролита упарить, то мы снова получим этот же электролит в том же количестве, что и до растворения, так как произойдет обратный процесс — моляризация.
➡️ 65. Чем отличается электролит от неэлектролита по типу химической связи и по поведению в растворе?
66. Почему для процесса электролитической диссоциации необходимо, чтобы растворитель имел дипольные молекулы, а электролит—ионный или полярный характер химической связи?
67. Почему вещества с неполярными молекулами не могут быть электролитами?
68. Сформулируйте, что такое электролитическая диссоциация. Выучите определение наизусть.
60. Чем отливается процесс моляризации от диссоциации? (См. Ответ)
Основные положения теории электролитической диссоциации
Диссоциацию электролитов в растворе впервые объяснил в 1887 г. шведский ученый Арреннус. Он сформулировал основные положения теории, которая была им названа теорией электролитической диссоциации,
Основные положения этой теории следующие:
- Все вещества, растворы которых проводят электрический ток (электролиты), под действием растворится распадаются на положительно и отрицательно заряженные частицы — ионы.
- Если через раствор пропускать постоянный электрический ток, то положительно заряженные ионы будут двигаться к отрицательному полюсу — катоду, поэтому они называются катионами. Отрицательно заряженные ионы будут перемещаться к положительному полюсу — аноду, поэтому они называются анионами. Общий заряд катионов в растворе равен общему заряду анионов, поэтому раствор всегда бывает электронейтральным.
- Ионы и атомы одних и тех же элементов весьма отличаются друг от друга по свойствам. Например, ионы меди имеют синюю окраску, которой обязан своим цветом медный купорос, а свободная медь — это металл красного цвета. Атомы натрия реагируют с водой, выделяя из нее водород и образуя щелочь, тогда как ионы натрия с водой практически не реагируют.
Ионы хлора бесцветны, не ядовиты, не имеют цвета и запаха, что видно при рассматривании того же раствора хлористого натрия, а сам хлор — это зеленовато-желтый ядовитый газ с характерным резким запахом.
Для того чтобы при написании отличить атом от иона, у иона справа вверху указывают знак заряда и его величину.
Например:
- Атом натрия — Nа, а ион натрия — Na+ (читается: «однозарядный катион натрия»).
- Атом меди — Сu, а ион меди — Сu2+ (читается: «двухзарядный катион меди»).
- Атом алюминия — Аl, а ион алюминия — Аl3+ (читается: «трехзарядный катион алюминия»).
- Атом серы — S, а ион серы — S2-; (читается: «двухзарядный анион серы»).
- Атом хлора Сl, а ион хлора Сl—, и т. д.
➡️ 70. Что такое ионы?
71. Чем ионы отличаются от нейтральных атомов?
72. Какие ионы называются катионами, какие—анионами и почему?
73. Как отличить в записи ион от нейтрального атома (приведите примеры)?
74. Назовите следующие ионы: Fe2+, Fe3+, К+, Вr—. (См. Ответ)