Коэффициент активности это показатель, используемый в термодинамике для представления отклонений от идеального поведения в комбинации синтетических веществ.
В идеальной смеси крошечные взаимодействия между каждой парой сложных видов являются чем-то очень похожим (или явно одинаковым, изменение энтальпии расположения и объемного разнообразия при смешивании равно нулю).
Таким образом, свойства комбинаций могут быть прямо сообщены в отношении основных фокусов или промежуточных факторов воздействия веществ, присутствующих, например, в законе Рауля.
Отклонения от идеальности объясняются корректировкой фиксации на коэффициент активности. Для сравнения, сочленения, включающие газы, могут быть адаптированы к неидеальности путем масштабирования факторов давления на полпути с помощью коэффициента летучести.

Что такое коэффициент активности
По большому счету, по мере того, как в превращается в ничто, коэффициент действия вещества B движется в сторону устойчивого состояния; эта зависимость является законом Генри для растворяемого.
Эти связи идентифицируются друг с другом с помощью условия Гиббса–Дюхема. Обратите внимание, что общие коэффициенты активности безразмерны.
Уравнение коэффициента активности
Идеальная смесь-это;
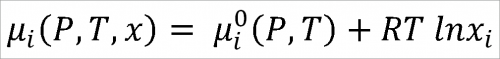
Идеальный коэффициент активности
В идеальной комбинации бесконечно малые связи между каждой парой составных видов являются чем-то очень похожим (или явно одинаковым, изменение энтальпии расположения и объемного разнообразия при смешивании равно нулю).
Таким образом, свойства комбинаций могут быть прямо сообщены в отношении основных фиксаций или промежуточных факторов давления веществ, присутствующих, например, закон Рауля.
Отклонения от идеальности объясняются регулировкой фокуса по коэффициенту действия.
Аналогичным образом, сочленения, включающие газы, могут быть адаптированы к неидеальности путем масштабирования факторов давления на полпути коэффициентом летучести.
Коэффициент активности в электрохимии
Считается, что коэффициент активности использует термодинамику для представления отклонений от идеального поведения в комбинации синтетических веществ.
Информация о коэффициентах активности особенно важна в отношении электрохимии, поскольку расположение электролитов часто далеко от идеального из-за воздействия ионного воздуха.
Кроме того, они особенно важны в отношении почвоведения из-за низких объемов растворяемых и, как следствие, высокой конвергенции электролитов.
Коэффициент активности воды
Оценка согласованного значения b для CO2 составляет 0,11 при 10°C и 0,20 при 330°C, где b-количество частиц, доставленных в результате разделения одного атома распавшейся соли, b-молярность соли, распавшейся в воде, φ-осмотический коэффициент воды, а согласованное значение 55,51 относится к молярности воды.
В приведенном выше условии активность растворяемого вещества (в данном случае воды) рассматривается как противоположно соответствующая количеству частиц соли по сравнению с количеством растворяемого вещества.
Ионный коэффициент активности
Ионная сила ответа зависит от концентрации электролита и определяется:
где c-молярность конкретной частицы, а z-заряд частицы. Это и есть причина, по которой KN полагается на фиксацию электролитом.
Близкий взгляд на условие Дебая-Хюккеля показывает, что γ уменьшается по мере расширения заряда частиц, гидратированный ионный промежуток уменьшается, а ионная сила расположения увеличивается. Влияние ионной силы на коэффициент активности в значительной степени зависит от заряда частицы.
Коэффициент активности — это доля того, насколько успешно частица может взаимодействовать в устройстве.
В ослабленных механизмах (μ Поскольку расположение оказывается более слабым (меньше ионных соединений), γ 6 1 и aA 6.
Для беспартийных растворенных веществ γ = 1.
Химия коэффициента активности
Коэффициент активности, в науке, пропорция комплексного действия любого вещества к его молярному фокусу.
Преднамеренная группировка вещества может не быть точным показателем его синтетической жизнеспособности, как указано в условии для конкретного ответа.
В этом случае коэффициент действия устанавливается дискретно и используется, а не фокусируется в расчетах.
Коэффициент летучести и активности
В наши дни использование этих моделей поддерживается размышлениями о летучести f, которая заменяет синтетический потенциал µ, в то же время не хватает его недостатков.
Коэффициент летучести, φ, определяет связь между летучестью фреймворка и уровнем фактора нажатия.
В исключительном случае идеального газа летучесть приближается к базовому давлению, что означает, что коэффициент летучести возрастает до нуля.
Коэффициент активности групп животных в ответе указывает на связь между подлинной летучестью и летучестью по сравнению с идеальным расположением (определяется с использованием правила Льюиса-Рэндалла).
Это при аналогичных подозрениях на температуру, давление и Создание.
Часто задаваемые вопросы и ответы о коэффициенте активности?
Почему важен коэффициент активности?
Ans. Регулировка кротовых частей или фиксаций по коэффициентам действия обеспечивает успешное выполнение сегментов и, следовательно, позволяет применять такие формулировки, как закон Рауля и константы баланса, как к идеальным, так и к неидеальным комбинациям.
Информация о коэффициентах активности особенно важна в отношении электрохимии, поскольку организация электролитов часто далека от идеальной из-за воздействия ионного климата. Кроме того, они особенно важны в отношении почвоведения из-за низких объемов растворяемых и, следовательно, высокой концентрации электролитов.
Что означает высокий коэффициент активности?
В термодинамике коэффициент активности используется для определения неидеального поведения комбинации или отклонения от идеальности, как это предусмотрено законом Рауля. В более актуальном смысле это характеризует уход от склонности составляющих атомов от комбинации.
Таким образом, если коэффициент действия меньше 1,0, это свидетельствует о том, что частицы обладают высокой привлекательной способностью, и, следовательно, для их изоляции требуется больше энергии.
Это дополнительно называется отрицательным отклонением от закона Рауля, поскольку реальный коэффициент давления дыма в смеси не так велик, как это предусмотрено законом Рауля.
Модель: (CH3)2CO и хлороформ. В применении для рафинирования такая ситуация создает самую крайнюю границу кипения над азеотропом.
Модель: вода (20,2%) — солянокислотная коррозия (79,2%), которая пузырится при 110°C, что превышает предельный уровень ее компонента.
3.6. 15 г CuSO4·5H2O растворили в 200 г 6 мас.% раствора CuSO4. Чему равна массовая доля сульфата меди, а также молярность, моляльность и титр полученного раствора, если его плотность составляет 1,107 г/мл?
