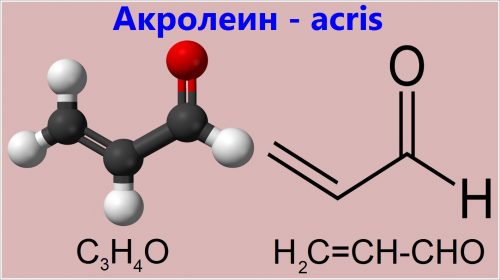
Самый простой ненасыщенный альдегид — это акролеин (пропеналь в научной терминологии). Это бесцветная жидкость с резким запахом.
Запах горелого жира возникает из-за того, что глицерин в горящих жирах распадается на акролеин (аналогично тому, как растительное масло нагревается до температуры дымления).
Его производят на заводе из пропилена и в основном используют в качестве биоцида и строительного материала для других химических веществ.
Физические свойства
Молярная масса 56,0633 ± 0,003 г/моль, плотность 0,843 г/см³, энергия ионизации 974,7911 кДж/моль.
Температура плавления −87 °C, кипения 52,7 °C, самовоспламенения 234 °C, критическая точка 232,85 °С, давление пара 29 кПа (20 °С).
Получение акролеина
В промышленности акролеин получают путём окисления пропена.
В качестве источника кислорода используется воздух, а в качестве гетерогенных катализаторов — оксиды металлов.
CH2CHCH3 + O2 → CH2CHCHO + H2O
С помощью этого метода в Северной Америке, Европе и Японии производится около 500 000 тонн акролеина в год.
Кроме того, кратковременное образование акролеина является источником всей акриловой кислоты и способствует реакции с акриловой кислотой.
Основная сложность заключается в конкурирующем переокислении этой кислоты.
Пропан является многообещающим, но сложным сырьём для производства акролеина (а затем превращения акролеина в акриловую кислоту).
При нагревании до 280 °C глицерин (также известный как глицерол) разлагается на акролеин:
(CH2OH)2CHOH → CH2 = CHCHO + 2H2O
При производстве глицерина для получения биодизельного топлива из растительных масел или животных жиров этот способ является привлекательным.
Хотя дегидратация глицерина была продемонстрирована, она не может конкурировать с нефтехимическим способом.
Лабораторные получение
Компания Degussa разработала первый промышленный способ получения акролеина, который включает конденсацию формальдегида и ацетальдегида:
HCHO + CHCHO → CH2 = CHCHO + H2O
В лабораторных условиях акролеин можно получить путём реакции бисульфата калия с глицерином (глицериновым эфиром).
Реакции связанные с акролеином
Поскольку акролеин является относительно электрофильным и реакционноспособным веществом, он обладает высокой токсичностью.
Он является сильным акцептором Михаэля, что объясняет, почему он хорошо реагирует с тиолами.
Он легко образует ацетали, одним из которых является алкилиден-пентаэритритоловый спироцикл, полученный из пентаэритритола.
Кроме того, акролеин сам по себе участвует в нескольких реакциях Дильса — Альдера.
Он является предшественником коммерческих ароматизаторов, таких как лираль, норборнен-2-карбоксальдегид и мирак альдегид, получаемых в результате реакций Дильса-Альдера.
При посредничестве тетрагидробензальдегида из акролеина также получают мономер 3,4-эпоксициклогексилметил-3,4-эпоксициклогексанкарбоксилат.
Кроме того, он помогает производить важные химические соединения, в том числе метилакрилат, полиакрилат и т. д.
Применение
В основном акролеин используется в качестве контактного гербицида в оросительных каналах для борьбы с подводными и плавающими сорняками, а также водорослями.
Он используется в оросительных и рециркулирующих водах в концентрации 10 частей на миллион.
Он используется в качестве биоцида в водах для гидроразрыва пласта и в качестве поглотителя сероводорода и меркаптанов в нефтегазовой промышленности.
Бифункциональность акролеина позволяет использовать его для получения множества ценных соединений.
Аминокислота метионин синтезируется путём сочетания синтеза метантиола и синтеза Штреккера.
Метилпиридины образуются при конденсации акролеина с ацетальдегидом и аминами.
Он также считается промежуточным продуктом при синтезе хинолинов по методу Краупа, но используется редко из-за своей нестабильности.
В присутствии кислорода и при концентрации более 22% в воде акролеин полимеризуется.
На цвет и текстуру полимера влияет окружающая среда. Со временем он полимеризуется сам с собой, образуя прозрачное жёлтое твёрдое вещество.
При контакте с водой он может превратиться в жёсткий, хрупкий пластик.
При подготовке биологических образцов для электронной микроскопии в качестве фиксатора часто используется акролеин.
Опасность для здоровья
Акролеин является сильным раздражителем для кожи, глаз и носовых пазух и наносит вред организму.
Алкилирование глутатиона является основным метаболическим путём для акролеина.
ВОЗ рекомендует ежедневное потребление 7,5 граммов акролеина на килограмм массы тела в качестве «допустимого суточного потребления акролеина».
В то же время акролеин содержится в картофеле фри (и других жареных продуктах) в количестве всего нескольких граммов на килограмм.
Управление здравоохранения и безопасности труда США установили допустимый предел воздействия акролеина на рабочем месте в 0,1 промилле (0,25 мг/м3) в восьмичасовом средневзвешенном значении.
Акролеин подавляет иммунную систему и может стимулировать регуляторные клетки, предотвращая развитие аллергии, с одной стороны, но повышая риск развития рака — с другой.
Одним из химических веществ, причастных к токсическому загрязнению реки Ким-Ким в 2019 году, был выявлен акролеин.

Добавить комментарий
Для отправки комментария вам необходимо авторизоваться.