Фосфор история открытия — более трехсот лет отделяют нас от того момента, когда гамбургский алхимик Геннинг Бранд (Хенниг Бранд) открыл новый элемент — фосфор.
Подобно другим алхимикам, Бранд пытался отыскать эликсир жизни или философский камень, с помощью которых старики молодеют, больные выздоравливают, а неблагородные металлы превращаются в золото.
Не забота о благе людском, а корысть руководила Брандом. Об этом свидетельствуют факты из истории единственного настоящего открытия, сделанного этим алхимиком.
Как открыли фосфор
В ходе одного из опытов он выпарил мочу, смешал остаток с углем, песком и продолжил выпаривание. Вскоре в реторте образовалось вещество, светившееся в темноте.
Правда, kaltes Feuer (холодный огонь), или «мой огонь», как Бранд его называл, не превращал свинец в золото и не изменял облика старых людей, но то, что полученное вещество светилось без подогрева, было необычно и ново.
Этим свойством нового вещества Бранд не замедлил воспользоваться. Он стал показывать фосфор различным привилегированным лицам, получая от них подарки и деньги.
Хранить тайну получения фосфора было нелегко, и вскоре Бранд продал ее дрезденскому химику И. Крафту.
Число демонстраторов фосфора увеличилось, когда рецепт его изготовления стал известен И. Кункелю и К. Кирхмейеру. В 1680 г. независимо от предшественников новый элемент был получен знаменитым английским физиком и химиком Робертом Бойлем.
Но вскоре Бойль умер, а его ученик А. Ганквиц изменил чистой науке и вновь возродил «фосфорную спекуляцию».
Интересный факт о фосфоре: В некоторых текстах фосфор упоминается как «дьявольский элемент» из-за его жуткого свечения, тенденции воспламеняться и потому, что это был 13-й известный элемент.
Лишь в 1743 г. А. Маркграф отыскал более совершенный способ получения фосфора и опубликовал свои данные для всеобщего сведения.
Это событие положило конец брандовскому бизнесу и послужило началом серьезного изучения фосфора и его соединений.
На первом, пятидесятилетием этапе истории фосфора, кроме открытия Бойля, лишь одно событие отмечено историей науки: в 1715 г. Генсинг установил наличие фосфора в мозговой ткани.
После опытов Маркграфа история элемента, приобретшего много лет спустя номер 15, стала историей многих больших открытий.
Все о фосфоре
В 1769 г. Ю. Ган доказал, что в костях содержится много фосфора. То же самое подтвердил через два года знаменитый шведский химик К. Шееле, предложивший способ получения фосфора из золы, образующейся при обжиге костей.
Еще несколькими годами позже Ж. Л. Пруст и М. Клапрот, исследуя различные природные соединения, доказали, что фосфор широко распространен в земной коре, главным образом в виде фосфата кальция.
Больших успехов в изучении свойств фосфора достиг в начале 70-х годов XVIII в. великий французский химик Антуан Лоран Лавуазье.
Сжигая фосфор с другими веществами в замкнутом объеме воздуха, Лавуазье доказал, что фосфор — самостоятельный элемент, а воздух имеет сложный состав и слагается по крайней мере из двух компонентов — кислорода и азота.
«Таким образом он впервые поставил на ноги всю химию, которая в своей флогистической форме стояла на голове». Так Ф. Энгельс писал о работах Лавуазье в предисловии ко второму тому Kaпитала».
В 1709 г. Дондональд доказал, что соединения фосфора необходимы для нормального развития растений.
В 1839 г. другой англичанин, Лауз, впервые получил суперфосфат — фосфорное удобрение, легко усвояемое растениями.
Фосфор необходим для живых организмов. В среднем у взрослого человека содержится около 750 граммов фосфора.
В организме человека он содержится в ДНК, костях и в виде иона, который используется для сокращения мышц и нервной проводимости.
Открытие аллотропии фосфора
В 1847 г. немецкий химик Шреттер, нагревая белый фосфор без доступа воздуха, подучил новую разновидность (аллотропную модификацию) элемента № 15 — красный фосфор.
А уже в XX в., в 1934 г., американский физик П. Браджыен, изучая влияние высоких давлений на разные вещества, выделил похожий на графит черный фосфор.
Таковы основные вехи в истории элемента № 15. Теперь проследим» что последовало за каждым из этих открытий.
«В 1715 году Генсинг установил наличие фосфора в мозговой ткани… В 1769 году Ган доказал, что в костях содержится много фосфора»
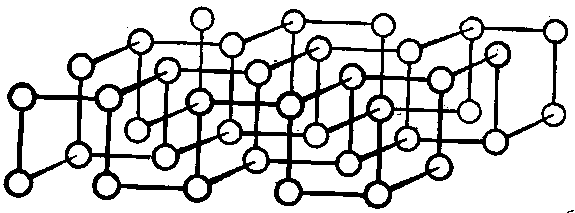
Рис. Структура черного фосфора
Фосфор аналог азота
Хотя физические и химические свойства этих элементов очень сильно различаются, есть у них. и общее, в частности то, что оба эти элемента совершенно необходимы животным и растениям. Академик А. Е.
Ферсман называл фосфор «элементом жизни и мысли», ж это определение вряд ли можно отнести к категории литературных преувеличений.
Фосфор обнаружен буквально во всех органах зеленых растений: в стеблях, корнях, листьях, но больше всего его в плодах и семенах. Растения накапливают фосфор и снабжают им животных.
В организме животных фосфор сосредоточен главным образом в скелете, мышцах и нервной ткани.
Фосфор получают из фосфата кальция путем нагревания породы в печи с образованием паров тетрафосфора.
Фосфор в теле человека
Из продуктов человеческого питания особенно богат фосфором желток куриных яиц.
Тело человека содержит в среднем около 1,5 кг элемента № 15. Из этого количества 1,4 кг приходится на кости, около 130 г-на мышцы и 12 г —на нервы и мозг.
Почти все важнейшие физиологические процессы, происходящие в нашем организме, связаны с превращениями фосфор-органических веществ. В состав костей фосфор входит главным образом в виде фосфата кальция.
Зубная эмаль — это тоже соединение фосфора, которое по составу и кристаллическому строению соответствует важнейшему минералу фосфора апатиту Ca5(PО4)3(F, Сl).
Круговорот фосфора в природе
Естественно, что, как и всякий жизненно необходимый элемент, фосфор совершает в природе круговорот. Из почвы его берут растения, от растений этот элемент попадает в организмы человека и животных.
В почву фосфор возвращается с экскрементами и при гниении трупов. Фосфоробактерии переводят органический фосфор в неорганические соединения.
Однако в единицу времени из почвы выводится значительно больше фосфора, чем поступает в почву. Мировой урожай сейчас ежегодно уносит с полей больше 3 млн. т фосфора.
Естественно, что для получения устойчивых урожаев этот фосфор должен быть возвращен в почву, и потому нет ничего удивительного в том, что мировая добыча фосфоритной руды сейчас составляет значительно больше 100 млн. т в год.
Производство белого фосфора является очень вредным для экологии. К тому же, его отходы легко воспламеняются.
Однако в настоящее время ученые придумали способ, благодаря которому можно очистить территорию от вредного вещества.
Фосфор в земной коре
«…Пруст и Клапрот доказали, что фосфор широко распространен в земной коре, главным образом в виде фосфата кальция»
В земной коре фосфор встречается исключительно в виде соединений. Это главным образом малорастворимые соли ортофосфорной кислоты; катионом чаще всего служит ион кальция.
На долю фосфора приходится 0,08% веса земной коры. По распространенности он занимает 13-е место среди всех элементов.
Минералы фосфора
Фосфор содержится не менее чем в 190 минералах, из которых главнейшие: фторапатит Ca5(PО4)3F, гидроксилапатит Са5(РО4)3ОН, фосфорит Са3(РО4)2 с примесями.
Реже встречаются вивианит Fe3(РО4)2•8Н2О, монацит (Се, La)РО4, амблигонит LaAl(PО4)F, трифилит Li(Fe, Мn)РО4 и еще реже ксенотим YPО4 и торбернит Cu(UО3)2[PО4]2•12H2О.
Минералы фосфора делятся на первичные и вторичные. Из первичных особенно распространены апатиты, часто встречающиеся среди пород магматического происхождения. Эти минералы образовались в момент становления земной коры.
В отличие от апатитов фосфориты залегают среди пород осадочного происхождения, образовавшихся в результате отмирания живых существ. Это вторичные минералы.
В виде фосфидов железа, кобальта, никеля фосфор встречается в метеоритах. Разумеется, этот распространенный элемент есть и в морской воде (6 •10-6%).
«Лавуазье доказал, что фосфор — самостоятельный химический элемент…»
Свойства фосфора
Фосфор — неметалл (то, что раньше называли металлоид) средней активности. На наружной орбите атома фосфора находятся пять электронов, причем три из них не спарены. Поэтому он может проявлять валентности 3—, 3+ и 5+.
Для того чтобы фосфор проявлял валентность 5+, необходимо какое-либо воздействие на атом, которое бы превратило в неспаренные два спаренных электрона последней орбиты.
Фосфор часто называют многоликим элементом. Действительно, в разных условиях он ведет себя по-разному, проявляя то окислительные, то восстановительные свойства.
Многоликость фосфора — это и его способность находиться в нескольких аллотропных модификациях.
Аллотропные модификации фосфора
Пожалуй, самая известная модификация элемента № 15 —мягкий, как воск, белый или желтый фосфор. Это ее открыл Бранд, и благодаря ее свойствам элемент получил свое имя: по-гречески «фосфор» значит светящийся, светоносный.
Молекула белого фосфора состоит из четырех атомов, построенных в форме тетраэдра. Плотность 1,83, температура плавления 44,1° С.
Белый фосфор ядовит, легко окисляется. Растворим в сероуглероде, жидких аммиаке и S02, бензоле, эфире. В воде почти не растворяется.
При нагревании без доступа воздуха выше 250° С белый фосфор превращается в красный. Это уже полимер, но не очень упорядоченной структуры.
Реакционная способность у красного фосфора значительно меньше, чем у белого. Он не светится в темноте, не растворяется в сероуглероде, не ядовит . Плотность красного фосфора намного больше, структура мелкокристаллическая.
Фиолетовый, коричневый и черный фосфор
Менее известны другие, еще более высокомолекулярные модификации фосфора — фиолетовый, коричневый и черный, отличающиеся одна от другой молекулярным весом и степенью упорядоченности макромолекул.
Черный фосфор, впервые полученный П. Бриджменом в условиях больших давлений (200 тыс. атм при температуре 200ºС), скорее напоминает графит, чем белый или красный фосфор.
Эти модификации лабораторная экзотика и в отличие от белого и красного фосфора практического применения пока не нашли.
Применение фосфора
Главные его потребители — производство спичек, металлургия, химические производства. В недавнем прошлом часть получаемого элементного фосфора расходовалась на военных предприятиях, его использовали для приготовления дымовых и зажигательных составов.
Металлурги обычно стремятся избавиться от примеси фосфора в металле — он ухудшает механические свойства, по иногда фосфор вводят в сплавы умышленно.
Это делается, когда нужно, чтобы при затвердевании металл немного расширился и точно воспринял очертания формы.
Широко используется фосфор и в химии. Часть его идет на приготовление хлоридов фосфора, нужных при синтезе некоторых органических препаратов.
Стадия производства элементного фосфора есть и в некоторых технологических схемах производства концентрированных фосфорных удобрений.
Статья на тему фосфор история