Строение молекулы азотной кислоты состоит из:
- Из одного атома водорода (валентность — I).
- Атома азота (валентность — IV).
- Трёх атомов кислорода (валентность — III).
Это сильная неорганическая кислота, отвечающая высшей степени окисления азота (+5).
Одна из электронных пар атома азота принадлежит одновременно трём атомам: двум атомам кислорода и атому азота – трёхцентровая связь.
С водой смешивается в любых соотношениях, в чистом виде дымящая на воздухе жидкость с удушливым запахом.
Строение молекулы азотной кислоты HNO3
Атомы элементов второго периода не имеют свободных d-подуровней. Поэтому фтор проявляет только одну валентность, равную единице, кислород — двухвалентен, а азот — трехвалентен.
Как же в таком случае объяснить строение молекул азотной кислоты HNO3?
Приводимая обычно в учебниках структурная формула: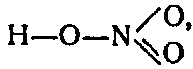
Строение молекулы HNO3 следует выражать формулой:
Один электрон атома азота переходит в электронную оболочку атома кислорода.
Возникший при этом ион N+
образует четыре ковалентные связи. Таким образом, в молекуле азотной кислоты азот действительно пятивалентен, однако одна его связь ионная, а другие четыре — ковалентные.
У азотной кислоты HNO3 структурная формула совершенно равнозначна, но, поскольку из опыта известно, что два не соединенных с водородом атома кислорода в молекуле HNO3 неразличимы, каждая из этих формул в отдельности неверна.
Лишь вместе они правильно отражают строение азотной кислоты.
Чтобы показать это, пользуются знаком «резонанса» ⇔ ,который обозначает, что истинное строение выражается некоторой промежуточной формулой:
Не нужно путать знак резонанса со знаком обратимости (⇄).
Электроны не прыгают с одного атома кислорода на другой, чтобы «давать» то одну, то другую форму.
Реальная молекула соответствует наложению крайних структур.
Поскольку электрон имеет корпускулярно-волновую природу, его можно считать как бы «размазанным» между, двумя атомами кислорода.
Тогда вместо двух резонансных структур можно написать следующую формулу, отражающую строение молекулы азотной кислоты.
Быстрые ответы?
В молекуле азотной кислоты между двумя атомами кислорода и атомом азота две химические связи абсолютно одинаковые – полуторные связи.
В молекуле кислоты атом азота образует четыре ковалентные связи: три из них — по обменному механизму, а одну — по донорно-акцепторному.
Состоит из одного атома водорода, одного атома азота и трёх атомов кислорода.


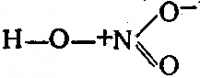
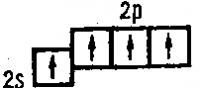
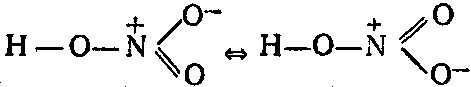

Добавить комментарий
Для отправки комментария вам необходимо авторизоваться.