Так как многие вещества могут находиться в трех агрегатных состояниях: газообразном, жидком и твердом, поэтому, например вода при 0° становиться твердой (твердое состояние вещества), но нагревание свыше 100° переходит в пар (газообразное состояние вещества).
Поэтому все вещества можно делить на кристаллические и аморфные.
Разница между ними в структуре их строения:
- В кристаллических веществах все частицы выстроены только в определенном порядке.
- В аморфных веществах этот порядок относителен.
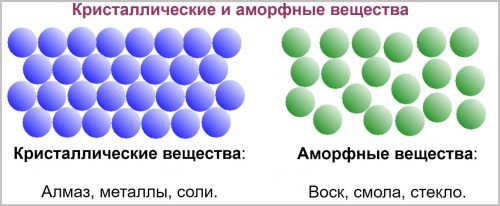
Кристаллические и аморфные вещества: структура свойства
Кристаллическими веществами называют, вещества в которых частицы располагаются в строго определенном для них порядке.
Примером таких веществ могут служить: алмаз, сахар, металлы, соли, щёлочи, большинство оксидов и простых веществ.
Аморфными веществами называют, вещества у которых нет строгого порядка в расположении частиц.
Примером таких веществ могут служить: большинство пластмасс, смола, воск, янтарь, пластилин, жевательная резинка и стекло.
Различить эти вещества можно по их свойствам:
- Так при ударе кристаллические вещества распадаются на мелкие кристаллики определённой формы.
- Аморфные вещества при разрушении образуют осколки неопределённой формы.
Различия между ними
Подавляющее большинство твердых тел имеет правильное кристаллическое строение. Однако при понижении температуры некоторые жидкости могут затвердевать без упорядочения структуры.
Образующиеся при этом вещества называются аморфными. К ним относятся, например, обычное стекло и каучук.
Исследования аморфных веществ показывают, что они состоят из беспорядочно расположенных мельчайших кристаллических образований.
Структура твердых тел зависит главным образом от условий, в которых происходит переход из жидкого (а в некоторых случаях — из газообразного) в твердое состояние.
Если такой переход осуществляется очень быстро, например, при резком охлаждении жидкости ниже температуры плавления, частицы не успевают выстроиться в правильную структуру и образуется аморфное или мелкокристаллическое вещество.
Получение из аморфных кристаллические вещества
При медленном охлаждении жидкости получаются крупные и правильной формы кристаллы.
Подбирая соответствующие условия, можно получить в кристаллическом состоянии почти все типично аморфные вещества.
В некоторых случаях, для того чтобы аморфное вещество закристаллизовалось, его приходится выдерживать при различных температурах.
Например, для получения кристаллических стекол — ситаллов — расплавленное стекло сначала охлаждают до оптимальной температуры образования зародышей кристаллизации.
Некоторое время выдерживают при этой температуре, затем вновь нагревают для более быстрого роста кристаллов и спустя некоторое время окончательно охлаждают.
В результате такой последовательности операций получается стекло, состоящее из равномерно распределенных по всему объему мелких кристалликов, спаянных друг с другом пленками аморфного вещества.
Ситаллы обладают исключительно высокой прочностью и применяются для многих строительных работ.
Различие между кристаллическими и аморфными веществами особенно сильно проявляется в их отношении к нагреванию.
В то время как любое кристаллическое тело плавится при строго определенной температуре, аморфные вещества постоянной точки плавления не имеют.
С повышением температуры аморфные постепенно размягчаются, начинают растекаться и, наконец, становятся совсем жидкими.
Установить момент перехода аморфного вещества из твердого состояния в жидкое не представляется возможным. Поэтому аморфные тела можно считать просто очень вязкими жидкостями.
Спайность кристаллических веществ
Другим характерным свойством, отличающим кристаллические вещества от аморфных, является анизотропия или неравно свойственность кристаллов.
Так, если из кубика хлорида натрия вырезать в различных направлениях три столбика одинакового поперечного сечения и испытать их на разрыв, то окажется, что все они имеют различную прочность.
Столбик, соединяющий противоположные грани куба, разорвется при нагрузке 570 г/мм2.
Точно такой же столбик, вырезанный параллельно диагонали грани куба, выдержит напряжение вплоть до 1150 г/мм2, А столбик, вырезанный по пространственной диагонали куба, окажется самым прочным: он разорвется при усилии, превышающем 2150 г/мм2.
Если проделать аналогичный опыт со стеклянным кубиком (аморфное вещество), то таких различий в свойствах мы уже не встретим.
Вследствие неодинаковой механической прочности в различных направлениях кристаллы при ударе способны раскалываться по определенным плоскостям.
Это их свойство называется спайностью.
Например, свинцовый блеск (PbS) и хлорид натрия образуют при дроблении правильные кубы, плавиковый шпат (СаF2) — октаэдры, а слюда — пластинки.
Если одну из таких пластинок покрыть тонким слоем воска или парафина и прикоснуться к ней острым концом тонкой стеклянной палочки, получится овальное пятно, форма которого доказывает, что теплопроводность слюды анизотропна.
Электрические свойства кристаллов
Очень интересными являются электрические свойства кристаллов. Они электризуются при трении, сжатии, растяжении и, кроме того, при изменении температуры.
Если большой и хорошо образованный кристалл горного хрусталя нагреть в закрытом сосуде, а затем быстро охладить, то он, подобно натертому о сукно янтарю, начинает притягивать мелко нарезанную папиросную бумагу.
Однако в отличие от янтаря или эбонитовой палочки хрусталь электризуется неравномерно. В этом нетрудно убедиться, проделав следующий опыт: наэлектризуйте кристалл горного хрусталя.
Электризация горного хрусталя
Приготовьте однородную смесь из тонко измельченных порошков сурика (минеральная краска, содержащая до 60% оксида железа) и серы и заполните ею солонку или перечницу.
Сделайте из марли небольшое сито; для этого натяните кусок марли на пяльцы или любой другой обруч. Возьмите в одну руку сито, в другую — солонку и осторожно, небольшими порциями, высыпайте порошок на сито, под которым лежит наэлектризованный кристалл горного хрусталя.
Порошок не ляжет равномерно по всей поверхности кристалла, а покроет только его ребра, которые станут попеременно желтыми и красными (рис.).
Неожиданный результат опыта объясняется тем, что частички серы и сурика, проходя сквозь отверстия в марле, наэлектризовались от трения друг о друга.
Сера зарядилась отрицательно, а сурик — положительно. Падая на кристалл, наэлектризованные частички притянулись его противоположно заряженными частями и образовали полосы.
Если проделать аналогичный эксперимент с кристаллом турмалина, то один его конец станет красным от сурика, а другой желтым от серы.
Быстрые ответы?
При нагревании аморфные (например стекло, пластилин) постепенно размягчаются и переходят в жидкое состояние.
Кристаллические (например металлы, алмаз) плавятся и кипят при определённых температурах.
Простым плавлением превратить кристаллическое тело в аморфное не получится. Потому, что в процессе будет преобладать рекристаллизация и из расплава будут расти кристаллики при охлаждении.
Вещества, в которых наблюдается отсутствие кристаллических областей

Добавить комментарий
Для отправки комментария вам необходимо авторизоваться.