Водородная связь это специфическая химическая связь, значительно более слабая, чем ионная или ковалентная, но более сильная, чем обычное межмолекулярное взаимодействие.
Энергия водородной связи составляет 20—30 кдж/моль.
Она обусловлена способностью атома водорода, соединенного с электроотрицательным элементом, глубоко внедряться в электронную оболочку близко расположенного, но ковалентно с ним не связанного, отрицательно поляризованного атома.
Водородная связь наиболее характерна для соединений фтора, кислорода, азота и в меньшей степени хлора и серы. Рассмотрим несколько конкретных примеров.
Что такое водородная связь
Поскольку межмолекулярные силы имеют электростатическую природу, они возрастают с увеличением молекулярных масс, т. е. с усложнением электронного строения взаимодействующих частиц.
С ростом молекулярной массы М изучаемых однотипных соединений обычно наблюдается повышение температуры их кипения, например:
F2 (—138,3°С), Cl (—33,7°С), Вr2 (58°С), I2 (138°С).
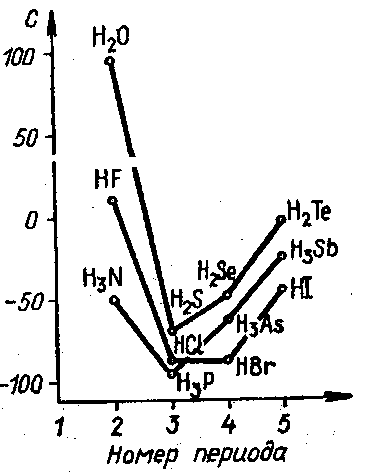
Однако при сопоставлении свойств гидридов элементов главных подгрупп V, VI и VII групп периодической системы обнаруживаются исключения из этого правила (рис.).
Рис. Температуры кипения некоторых гидридов
Так, фтороводород, вода и аммиак кипят при гораздо более высокой температуре, чем это можно было бы ожидать, исходя из малых значений их молекулярных масс.
Это объясняется возникновением между молекулами дополнительных сил притяжения за счет образования водородной связи, первые представления о которой были развиты еще в 1887 г. русским ученым М. А. Ильинским.
Пример водородной связи
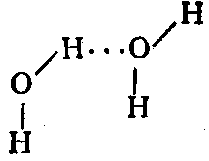
В молекулах воды связи Н—О сильно поляризованы и ведут себя как маленькие диполи с зарядом δ+ на водороде и δ— на кислороде.
В результате атом водорода одной молекулы взаимодействует с неподеленной парой электронов атома кислорода другой молекулы с образованием водородной связи:
Взаимодействие между молекулами воды оказывается настолько сильным, что даже в газообразном состоянии наряду с отдельными молекулами Н2О присутствуют их димеры (Н2O)2 и тримеры (Н2O)3.
В жидком состоянии молекулы воды образуют ассоциаты состава (Н2O)х.
Наиболее устойчивы удвоенные молекулы (Н2O)2, удерживаемые друг около друга двумя водородными связями.
Высокая температура кипения воды обусловлена дополнительной энергией, которую необходимо затратить, чтобы разрушить ассоциаты перед переводом молекул в газообразное состояние.
В жидком состоянии ассоциированы также молекулы фтороводорода и аммиака.
Газообразный фтороводород, кроме молекул HF, содержит полимеры состава вплоть до (HF)6:
Водородная связь возникает между молекулами органических соединений, содержащих полярные группы:
- —ОН,2.
- —NH2,
- —SH.
Особенно заметно она проявляется у спиртов и карбоновых кислот. Множество водородных связей содержат основные вещества биологического происхождения: белки, жиры и углеводы.
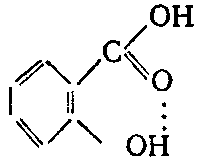
Водородная связь может образовываться и между двумя функциональными группами одной молекулы, как, например, в случае салициловой кислоты:
Наличие водородной связи устанавливают экспериментально с помощью различных физических и физико-химических методов.
Внутри и межмолекулярные водородные связи
Одним определяющих возможность образования прочных водородных является кислотный характер атома водорода.
Так, водородная связь образованная фтористым водородом,— одна из наиболее прочных связей.
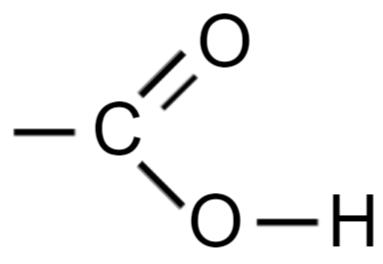
Уксусная кислота СН3СООН — представитель важного класса с кислотным атомом водорода.
Все члены этого класса содержат в своих молекулах так называемую карбоксильную группу:
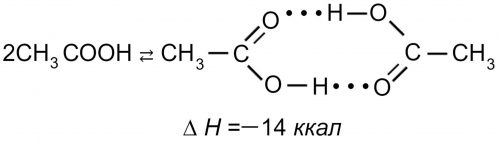
Для соединения такого типа возникновение водородной связи может привести к объединению молекул в пары с образованием циклической структуры:
В случае энергетически выгодной геометрической структуры с двумя водородными связями при стабилизации образующейся молекулы (7) выделяется 14 ккал.
Такая связь называется межмолекулярной водородной связью.
Водородные связи могут существовать также, когда группа О—Н и другой связывающийся атом расположены близко друг от друга в одной и той же молекуле.
При этом образуется цикл без изменения нормальных валентных углов. Такая связь называется внутримолекулярной водородной связью.
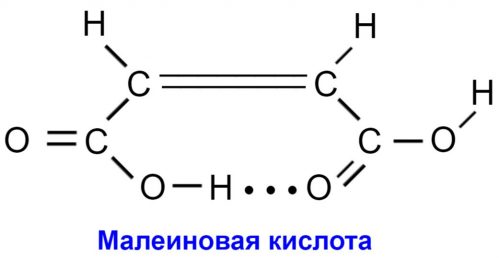
Примером внутримолекулярной водородной связи являются цис- и транс -формы кислоты НООС—CH = CH — СООН.
Транс-Форма (фумаровая кислота) имеет более высокую температуру плавления, чем цисформа (малеиновая кислота).
Помимо общих причин, связанных с формой молекул (упомянутых раньше в этой главе), существует другая причина такого различия.
Она заключается в возможности образования внутримолекулярной водородной связи между двумя группами — СООН малеиновой кислоты (но не фумаровой кислоты):
С другой стороны, в фумаровой кислоте все водородные связи образуются между молекулами (межмолекулярные связи), и в результате возникает более прочная кристаллическая структура.
Природа водородной связи
Мы видели, что в водородной связи атом водорода соединен с двумя другими атомами. Но правила возникновения связи предполагают, что у атома водорода, использующего только 1s-opбиту для образования связи, не могут возникнуть две ковалентные связи.
Мы должны найти объяснение образования второй связи.
Простейшее объяснение образования водородной связи базируется на полярной природе связей F—Н, О—Н и N—Н.
В такой молекуле, как Н2О, электронная пара, образующая связь в группе О—Н, смещена к ядру кислорода и удалена от ядра водорода.
Такой частично ионный характер связи О—Н ведет к тому, что атом водорода приобретает некоторый положительный заряд.
А это позволяет электронам другого атома приблизиться к протону, если даже протон уже связан.
Образуется вторая, более слабая связь.
Значение водородной связи
Водородные связи играют важную роль в определении таких свойств, как растворимость, температура плавления и температура кипения, и влияют на форму и устойчивость кристаллической решетки.
Они имеют чрезвычайно важное биологическое значение.
Например, вода настолько широко распространена в живой материи, что она должна оказывать влияние на химическое поведение многих биологи чески активных молекул, большинство из которых может образовывать водородные связи.
Вода может присоединяться с помощью водородных связей либо предоставляя протон для связи, как в:
либо принимая протон, как в
Кроме того, внутримолекулярные водородные связи — один из главных факторов в определении структуры таких биологических веществ, как белки.

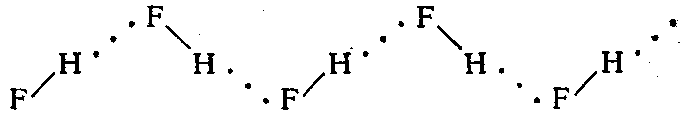
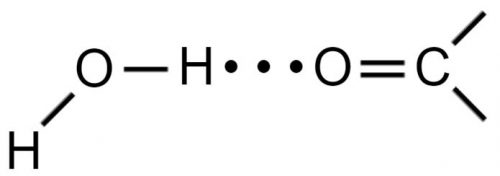
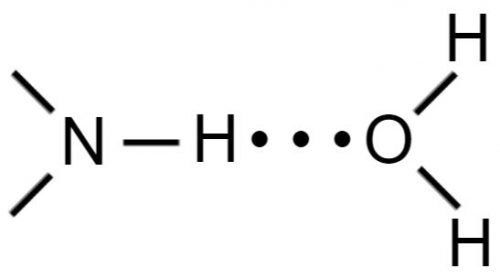
Добавить комментарий
Для отправки комментария вам необходимо авторизоваться.