Что такое ферменты и их строение
Природа и в этом случае обнаруживает тенденцию к экономии. Одно и то же соединение, например комплекс иона железа с порфирином, будучи связано с белками, выполняет различные каталитические функции: в одном ферменте это разложение пероксида водорода (фермент каталаза), в другом — реакция окисления пероксидом (перексидаза); тот же комплекс может функционировать в особых белковых системах как переносчик электронов (цитохромы) и т. д.
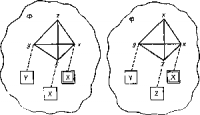
Рис. Схема строения комплекса фермент — субстрат (по Огстону).
Тетраэдр изображает молекулу субстрата, соединенную в трех точках с группами поверхности фермента. Группа х, окруженная двойной рамкой, активирует группу х в молекуле субстрата; таким образом, фермент различает две одинаковые группы х. На схеме показаны две возможные ориентации молекулы субстрата.
Если ферменты состоят из одного белка, то его активный центр представляет собой сочетание атомных групп, входящих в состав белковой цепи аминокислотных остатков. Хотя строение активных центров ферментов в общем изучено недостаточно, все же можно указать те важнейшие группы атомов, которые встречаются во многих ферментах. Это гидроксил аминокислоты серина, сульфгидрильная группа цистеина, кольцо амидазола, входящее в состав аминокислоты гистидина, карбоксильные группы аспарагиновой и глутаминовой кислот, аминогруппа аминокислоты лизина. Из этих групп и организуются разнообразные активные центры биологических катализаторов.
Прочность связи небелковой активной группы с белком фермента различна. Так, железопорфириновый комплекс прочно связан с белком, а, например, активная группа фермента из класса дегидрогеназ связана с белкой гораздо слабее и может переходить с одного белка на другой. Предлагали называть активную группу таких ферментов коферментом, белковую часть — апоферментом, а всю систему в целом — холоферментом. В момент реакции кофермент, белок и субстрат образуют общий комплекс.
Обычно специфичность фермента (т. е. его способность действовать именно на данное вещество, а не какое-либо другое) определяется природой белковой части; активные группы из числа тех, которые вообще можно отделить от белка, сами по себе гораздо менее активны и менее «разборчивы» в выборе субстрата.
При изучении ферментов естественно возникают два вопроса: какие реакции катализируют ферменты и каков механизм их действия?
Существует строгая классификация ферментов, учитывающая особенности реакций, ускоряемых этими биокатализаторами. Особенно важны следующие из них: разрыв химической связи между двумя атомами и последующее присоединение воды, т. е. гидролиз, перепое групп атомов от одной молекулы к другой, окислительно-восстановительные реакции (т. е. перенос электронов или атомов водорода), перестройка каркаса молекул — изомеризация и соединение двух молекул — конденсация.
Оказывается, с помощью катализаторов, ускоряющих эти типы реакций, можно осуществить очень большое число процессов и переделать любую молекулу так, чтобы получились другие, нужные организму соединения, а энергия могла бы быть использована наиболее целесообразным путем.
К ферментам гидролизам относятся ферменты, расщепляющие белки, — протеиназы (или протеазы), ферменты, расщепляющие жиры,— липазы, ферменты, действующие на углеводы,— карбогидразы. К этой группе относится и фермент фосфатаза, гидролизующая фосфорные эфиры. Характер реакции во всех случаях однотипен; разрывается связь между атомами в группах
и к освободившимся валентностям присоединяются водород Н и группа ОН. Например, гидролитическое расщепление белков под влиянием протеазы можно изобразить схемой, показывающей расщепление одной связи между атомами углерода и азота.
Переносы групп — явление, очень распространенное в биологических машинах. В клетках постоянно действуют транспортные потоки, переносящие «химические грузы» от одной молекулы к другой. Ферменты трансферазы организуют эти потоки. Так, фосфаттрансфераза катализирует перепое группы —Н2РО3 .
Другие трансферазы регулируют перенос аминогруппы NH2, ацетила , сульфатной группы SO3H, метила — СН3 и даже больших фрагментов углеводородных молекул.
Ферменты дегидрогеназы отнимают водород от какого-либо субстрата и передают его другому веществу, которое также может быть ферментом. Так, например, водород от молекулы молочной кислоты переходит сначала на активную группу (ко-фермент) лактикодегидрогеназы, т. е. дегидрогеназы молочной кислоты, а затем от восстановленного кофермента переходит на кофермент флавиновой дегидразы.
Следовательно, кофермент лактикодегидрогеназы в сущности является субстратом по отношению к флавиновым ферментам. Активных групп дегидрогеназ не слишком много, но, соединяясь с различными белками, эти коферменты образуют большое число различных дегидрогеназных систем, действующих на различные субстраты. По латинскому названию субстрата обычно называют и фермент. Так, фермент, отнимающий водород от молочной кислоты, называют, как мы видели, лактикодегидрогеназой, фермент, отнимающий водород от пировиноградной кислоты,— пироватдегидрогеназой, фермент, дегидрирующий янтарную кислоту, — сукциндегидрогеназой, яблочную — маликодегидрогеназой, спирт — алькогольдсгидрогеназой и т. д. Ферменты часто объединяются в общие системы посредством особых веществ — переносчиков, сходных по типу функций с коферментами. К таким веществам относятся, например, переносчики электронов — цитохромы. Их молекулы также состоят из белковой части и активной группы, представляющей собой комплексное соединение железа.
Сведения о составе активных центров и их групп более полны по отношению к тем ферментам, у которых эти группы имеют небелковую природу. В тех случаях, когда сам белок образует активный участок на поверхности молекулы, исследование затрудняется из-за сложной топографии этой поверхности и данные о составе активных центров менее надежны. Фермент, как правило, ускоряет однотипные реакции, т. е. это катализатор, который проявляет свойство избирательности или специфичности. Отношения между ферментом и его субстратом сравнивали с отношением ключа к замку. На самом деле специфичность ферментов изменяется в широких пределах. Так, фермент уреаза катализирует одну-единственную реакцию разложения мочевины и ни на какие другие субстраты не действует. Этот фермент обладает абсолютной специфичностью. Но, например, ферменты, катализирующие гидролиз сложных эфиров, гораздо менее специфичны в выборе субстрата и действуют на эфирные связи различно.
Насколько важно для действия фермента геометрическое расположение атомов в топ части молекулы, где идет химическое превращение, можно видеть па примере целлюлозы, которая в отличие от крахмала не поддается гидролизу ферментами кишечника человека, хотя различие между структурами молекул целлюлозы и крахмала очень невелико.
Еще более удивительные тонкости обнаружились в работе ферментов, когда для изучения биокатализаторов начали применять изотопы. Было выяснено, что при разложении аминомалоновой кислоты, меченной по карбоксилу, на оксид углерода (IV) СО2 и глицин меченый углерод (С13) попадает целиком в глицин:
НООС—СН (N Н2)—СООН → СО2 + N Н2—СН 2—СООН
Это может произойти лишь при условии, что фермент удерживает молекулы в трех точках, причем точки эти неодинаковы.
На рисунке сверху показан общий случай, когда молекула вещества, на которое действует фермент (т. е. молекула субстрата), закрепляется на поверхности фермента (Ф) тремя точками. Это могут быть точки х, х, у (две точки одинаковы — это две одинаковые группы в молекуле субстрата) или при другой взаимной ориентации — точки х, у, г. Каждая из них связана с соответствующими точками фермента. Одна из точек фермента X (окруженная двойной рамкой) делает группу субстрата X реакционноспособной. При любом расположении молекулы субстрата в той точке, которая связана с X в рамке, и будет происходить химическое превращение. Тогда, если, например, в этой точке X идет декарбоксилирование, весь меченый углерод попадает в состав глицина. Следовательно, фермент различает карбоксилы, которые по всем свойствам кажутся нам вполне одинаковыми. Теоретические расчеты также показывают, что большую химическую активность фермента и реакции между двумя молекулами А и В (А, например, может быть эфиром, а В водой) цель) нельзя объяснить просто сближением и А и В на поверхности фермента и взаимной ориентацией. Необходимо предположить, что молекулы субстрата связываются с ферментом в нескольких точках. Только тогда вероятность необходимого для реакции взаимного расположения молекул возрастет настолько, что можно будет понять, почему фермент так сильно ускоряет реакцию. К сожалению, опыт дает пока еще слишком мало сведений о природе этих точек и их числе.
В современных представлениях о механизме действия ферментов все большее распространение получает взгляд, согласно которому активный участок молекулы фермента не является «жесткой» конструкцией, а представляет собой лабильную, подвижную систему из нескольких атомных групп. Взаимодействие ее с молекулой субстрата ведет к разрывам некоторых химических связей и возникновению новых, причем меняется не только субстрат, но и фермент. Это удалось доказать, наблюдая изменения спектров поглощения макромолекул белка фермента после того, как он вступил в реакцию с субстратом.
Предметом исследования служил фермент пируваткиназа, ускоряющий разложение пировиноградной кислоты. Фермент активизируется ионами марганца и таллия; это дало возможность проверить предположение об изменениях в молекуле белка еще и другим способом. С помощью метода, основанного на измерениях поглощения электромагнитных волн ядрами марганца и таллия в магнитном поле (метод ЯМР), было обнаружено, что присоединение к белку субстрата приводит к сокращению расстояния между ионами металлов с 0,82 до 0,49 нм. Ионы металлов закреплены на различных участках белковой молекулы, и сближение их в процессе катализа указывает на существенное изменение формы макромолекулы.
Макромолекула белка-фермента не представляет собой чего-то похожею па шар с гладкой поверхностью. По всем данным ее геометрическая форма тоже приспособлена к выполнению каталитических функций. Несомненно, что на поверхности некоторых ферментов, например рибонуклеазы, имеются своеобразные углубления — «щели». Молекула субстрата, попадая в них, подвергается согласованному действию атомных групп. В результате изменяется строение и субстрата и фермента. После превращения молекулы субстрата в конечный продукт взаимное расположение активных групп фермента восстанавливается. Ферментный катализ гораздо более сложен, чем тот, к которому привыкли химики, работающие с обычными техническими катализаторами, зато перспективы в области биокатализа безграничны.
Строение ферментов
активный центр биологического катализатора. Высказывалось мнение, что строгая специфичность фермента (его «узкая специальность»— настроенность только на определенную реакцию) зависит от окружения активной группы.
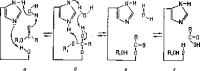
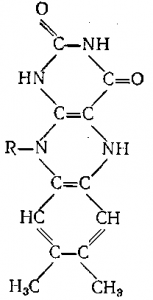
Рис. 2. Схема гидролиза сложного эфира Р1—О—СО—R под действием химотрипсина.
Примером гидролитического фермента может служить химотрипсин, который получается при воздействии особого вещества— трипсиногена (трипсиноген синтезируется в поджелудочной железе) на трипсин. Химотрипсин ускоряет гидролиз пептидных связей в слабощелочной среде, он катализирует также и гидролиз некоторых сложных эфиров. Предполагают, что активный участок молекулы химотрипсина состоит из четырех остатков аминокислот: серина, изолейцина и двух остатков гистидина. Составные части активного центра должны быть очень точно расположены относительно друг друга и молекулы субстрата.
Точное пространственное соответствие — важный фактор в катализе. А. А. Баландин указал на общее значение этого фактора при исследовании гетерогенных катализаторов менее сложного состава (металлы, оксиды). Тонкие детали биологических катализаторов и группы атомов молекул их субстратов тоже подчиняются требованиям пространственного, т. е. структурного, соответствия. При этом, конечно, нельзя рассматривать молекулу субстрата и часть молекулы фермента просто как изделия из инертного материала. Термин «соответствие» означает наиболее удобное для катализа расположение, и котором учитываются силы электростатического взаимодействия между частями молекул, эффекты поляризации и другие факторы. Взаимное расположение молекулы субстрата и атомов активного участка должно быть таким, чтобы общая конфигурация как можно меньше отличалась от переходного комплекса реакции. Это облегчает развязывание реакции и характерно для биокаталитического процесса. В химотрипсине поддержание «жесткой» конфигурации активного центра лежит «на обязанности» изолейцина. Достаточно, например, ввести ацил в этот аминокислотный остаток, как каталитическая активность исчезает.
По М. Бендеру, детально изучившему структуру химотрипсина, и данным Нейрата и Харли можно представить себе активный центр химотрипсина в виде петли, связывающей участки цепи от цистеина № 42 до цистеина № 58 и прямой цепи от цистеина № 191 до цистеина № 201. Аминокислотный остаток серина имеет № 195 и расположен недалеко от остатка гистидина № 57. Свертывание цепи обусловливает близость таких аминокислот, которые нормально отдалены друг от друга 134 аминокислотными остатками.
Что же происходит с гидролизуемой связью в этой сложной системе? На этот счет имеется несколько гипотез. Согласно одной из них на активном участке имеется группа ОН (от серина) и группа, содержащая реакционноспособный атом водорода (в гистидине — водород имидазольного ядра).
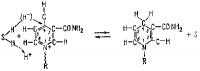
Реакция, например, гидролиза сложного эфира протекает так, как показано на рисунке 2. Водород имидазольной группы гистидина связан водородной связью с гидроксилом серина.
Положение а на рисунке является исходным: молекула сложного эфира R1—О—(СО)—R приближается к активному участку фермента. Стадия б представляет переход протона от остатка серина к кислороду группы R1—О—С, на стадии в остаток сложного эфира R — СО соединяется с остатком серина, а получившаяся молекула спирта R1OH покидает фермент. В реакцию вступает молекула воды и в результате гидролиза соединения ацил-фермента образуется молекула кислоты RCOOH; структура активного участка фермента полностью восстанавливается.
Анализ работы активного центра химотрипсина приводит к выводу, что фермент действует на молекулу субстрата одновременно в нескольких точках; такое соединенное воздействие различных атомных групп называют кооперативным. Благодаря этому эффекту даже слабые взаимодействия, суммируясь, могут произвести значительные изменения в структуре молекулы.
Хорошим примером сложного строения активного центра является также структура центра фермента ацетилхолинэстеразы, ускоряющего гидролиз ацетилхолипа. Этот фермент имеет особое значение. Его работа связана с передачей нервного импульса. В тех точках, в которых нервные клетки граничат друг с другом, передача сигнала от одной клетки (нейрона) к соседней зависит от наличия ацетилхолина. Изменение его концентрации, отвечающее нормальной работе связанных нейронов, т. е. передача сигнала, и регулируется ацетилхолинэстеразой.
Активный центр этого фермента состоит из двух участков: один функционирует как анион (анионный участок), а другой расщепляет сложноэфирную группу. Сложные эфиры называют эстерами, и поэтому участок носит название эстеразный.
Катионная часть ацетилхолина — именно группа — N(CH3)3 закрепляется на анионном участке, и вся молекула, поставленная таким образом «на якорь», подвергается гидролитическому расщеплению. В эстеразном участке, по-видимому, расположены рядом гидроксил аминокислоты серина и имидазольное кольцо гистидина. Как группа ОН и азот общими усилиями разрывают сложноэфирную связь, т. е. осуществляют реакцию гидролиза ацетилхолина.
Состояние молекулы ацетилхолина в водной среде, поэтому группа (СН3)3—N—OH в результате диссоциации приобрела положительный заряд [СН3)3—N—], а группа
отрицательный
Перейдем теперь к таким ферментам, активная группа которых имеет небелковую природу. Как мы уже упоминали, во время действия фермента химический процесс развертывается главным образом на некоторых определенных группах атомов кофермента. В связи с этим нет необходимости, изображая работу активной группы, выписывать полностью всю формулу группы, хотя бы она была и хорошо известна.
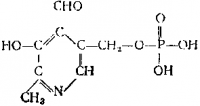
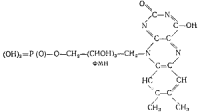
Фермент, катализирующий перенос аминогруппы (а также и ряд других реакций), содержит в качестве кофермента пиридоксальфосфат:
Действующей частью является альдегидная группа СНО, и поэтому кофермент иногда сокращенно обозначают R—СНО. С аминогруппой какой-либо аминокислоты R — NH2 группа СНО пиридоксальфосфата образует шиффово основание R — СН = NR, которое испытывает различные превращения. Например, в результате внутримолекулярной перестройки и гидролиза оно может перейти в соединение типа R — СН2— NH2, т. е. аминоформу кофермента. Последняя, реагируя с органической кислотой, передает ей аминогруппу, а кофермент восстанавливает свой состав. Аминогруппа таким образом оказывается перенесенной с одной кислоты на другую.
Ему свойственны и другие реакции, характеризующиеся разрывом связи С—С, но мы ограничимся декарбоксилированием ввиду исключительной важности этой реакции.
Кофермент кокарбоксилаза имеет следующее строение:
Действующей частью этой сложной молекулы является сочетание атомов азота, углерода и серы, расположенных в средней части молекулы кокарбоксилазы. Обозначив ее (по Грину и Гольдбергу) [N = СН — S].
Подчеркнем еще раз, что, указывая атомы, активно действующие в молекуле кофермента, мы не считаем все остальные лишними. Это совсем не так! Роль остальных атомов весьма существенна. Они влияют на реакционную способность тех атомов, которые непосредственно участвуют в процессе. В активном центре ацетилхолинэстеразы имеется группа ОН, принадлежащая серину. Установлено, что эта группа способна выполнять свои функции, только находясь в составе фермента. Если же просто взять серии, то его гидроксил оказывается гораздо менее реакционно способным, чем гидроксил остатка серина, находящегося в активной группе.
Во многих случаях остальные атомы способствуют также фиксации кофермента на белке или служат резервуаром энергии, необходимой для осуществления процесса, т. е. преодоления активационного барьера реакции. Перейдем теперь к ферментам, катализирующим перенос водорода.
Перенос атомов водорода и электронов чрезвычайно важен, так как энергия потока электронов может быть уловлена и запасена в азотофосфорном соединении, именно в аденозинтрифосфорной кислоте.
Перенос водорода осуществляется ферментами — дегидрогеназами. Кофермептамп их являются соединения, способные обратимо присоединять и отдавать водород. Коферменты обычно содержат сочетание органического основания с остатком углевода и фосфата или удвоенную группу той же природы, т. е.
(I)основание—углевод—фосфат—углевод—основание (II)
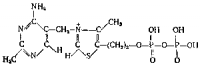
Особенно значительна в этом процессе роль никотинамидадениндинуклеотида (НАД). Полная формула кофермента НАД+ должна быть написана следующим образом:
На вышеприведенной схеме изображена окисленная форма кофермента и отмечена ионизация одной группы. Как видно, молекула НАД+ является катионом, так как атом азота пиридинового кольца несет положительный заряд. Однако при рН 7,5 заметно проявляется ионизация фосфатных групп, и общий заряд частицы кофермента оказывается равным — 1, он ведет себя как дипольный ион.
В реакции дегидрирования кофермент НАД+ получает от молекулы субстрата, которую обозначим SH2, два атома водорода. Доказано, что один из них в форме гидрильного иона (т. е. отрицательно заряженного иона Н—) переходит к углероду, как показано на схеме, а другой в виде положительного иона Н+ поступает в окружающую среду. В результате положительный заряд пиридинового кольца нейтрализуется, а молекула субстрата окисляется (теряет водород):
На схеме буквой R обозначен остаток, не принимающий непосредственного участия в реакции, но необходимый для проявления нужного уровня активности и обеспечения связи активной группы с белком. В некоторых ферментах (кофермент НАДФ) встречается и группа из трех фосфатных остатков; НАДФ участвует в переносе водорода в реакциях фотосинтеза. Тонкие детали процесса переноса водорода были изучены методами квантовой химии. По расчетам Б. и А. Пюльман, наиболее положительным в пиридиновом кольце является атом углерода в положении 4; отрицательные ионы вступают во взаимодействие главным образом с этой частью молекулы. На этом атоме имеется заряд, по величине меньший одного электронного заряда, т. е. в среднем атом С-4 — более положительный чем все остальные.
Присоединение к этой системе первого электрона атома водорода приводит к перераспределению электронной плотности, причем электрон не фиксируется у какого-либо определенного атома цикла. Присоединение второго электрона вызывает новое перераспределение плотности, в результате которого атом С-4 делается наиболее отрицательным; к этому атому и присоединяется протон Н+ — в итоге осуществляется гидридный перенос.
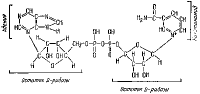
Активные группы дегидрогеназ типа флавинпротеидов (ФП) содержат или флавинмононуклеотид (ФМН), или флавинадениндинуклеотид (ФАД). Формулы этих веществ таковы:
Флавопротеиды способны отнимать водород и отдавать его большему числу различных веществ. Каталитические реакции с их участием требуют иногда присутствия ионов металлов, по-видимому, образующих лабильные комплексы (фермент — субстрат — металл — белок), в которых металл играет роль сцепки, это открывает дополнительные возможности для расширения каталитических функций.
Флавопротеиды присоединяют водород к атомам азота (в изоалоксазиновом цикле), так, что восстановленная форма активной группы имеет вид:
Перенос и активация кислотных (ацильных) групп осуществляется особым переносчиком, который обычно сокращенно обозначается символом KoA-SH. Молекула этого вещества-кофермента содержит серу.
Группа HS принимает деятельное участие в реакциях кофермента А. Смысл реакций, типичных для HS-KoA, заключается в том, что кислотная группа, присоединившись к коферменту, приобретает высокую химическую активность.
Активность повышается оттого, что одновременно АТФ распадается на АДФ и Ф, представляя необходимую для активации энергию. Так, например, если HS-KoA реагирует с уксусной кислотой, то получается ацетил-КоА.
Ацетил-КоА активен и может передать ацетильную группу другой молекуле. Далее мы и узнаем, насколько значительна роль кофермента в обмене жиров.
Молекула HS-KoA, если можно так выразиться, составная; она состоит из соединенных друг с другом остатков молекул, тиоэтаноламина (звено 1), аланина (звено 2), кислот — пантоненовой (звено 3) и пирофосфорной, рибозофосфата и аденина (звенья 4, 5 и 6).
Очень важной особенностью структуры ферментных белков является существование на их поверхности различных, но как-то взаимодействующих центров. Если, например, на фермент действует продукт реакции, ускоряемый данным ферментом, то белок фермента связывает молекулы продукта и при этом часто происходит резкое снижение активности. Однако молекула продукта попадает не на то место молекулы фермента, на котором связывается субстрат — продукт и субстрат, связаны с разными участками поверхности белка, и тем не менее активность фермента изменяется. Такие белки называют аллостерическими. Аллостеризм очень интересное и далеко еще не полностью изученное явление, вероятно, связано с изменением формы белковой молекулы, вызванным воздействием на нее того или иного (обычно низкомолекулярного) вещества.
Синтез ферментов
Нам пора разобрать один чрезвычайно серьезный вопрос. Все время, пока шла речь о химических реакциях, поддерживающих жизнь, мы упоминали о катализаторах, ведущих процессы превращения в нужном направлении и с надлежащей скоростью. Практически все реакции в биохимических системах являются каталитическими и набор ферментов, очевидно, столь же необратим для жизни, как и все известные ее химические носители.
Но откуда же берутся ферменты и почему они оказываются настроенными именно на те реакции, которые требуются клетке?
Подбор даже одного катализатора в технике — дело очень трудное, приходится производить сотни опытов в поисках избирательного и достаточно активного катализатора. Организм же с необыкновенной щедростью вовлекает в биохимические реакции десятки ферментов, а в случае надобности, как доказано, может синтезировать и такие, которые в норме у него отсутствуют.
Синтез ферментов — это прежде всего синтез белков, потому что все ферменты имеют белковую природу. Синтез белка идет на РНК, а строение РНК определяется в свою очередь ДНК. Отсюда вывод, что для синтеза данного фермента нужна определенная ДНК. Не вся огромная молекула ДНК требуется для создания соответствующей данному белку РНК, а только часть ее. ДНК находится в хромосомах, и те факторы, которые регулируют образование определенных белков (а следовательно, и ферментов), действуют на определенные участки ДНК, блокируя синтез тех или иных м-РНК.
Участок нуклеиновой кислоты, обеспечивающий наследственную передачу какого-либо признака, называется геном. Таким образом, образование ферментов контролируется генами. Часто употребляют формулу: один ген — один фермент. Это значит, что для синтеза фермента, настроенного на заданную реакцию, требуется один ген. Некоторые биохимики считают, что лучше писать: один ген — одна полипептидная цепь, потому что ген контролирует строительство только одной цепи аминокислотных остатков.
Клетка располагает полным набором всех требуемых для ее жизнедеятельности и размножения генов, но не все они действуют одновременно; смотря по необходимости включается то один, то другой ген и соответственно этому синтезируется белок с надлежащими (в частности, ферментативными) свойствами.
Отсюда вытекает, что синтез ферментов есть часть белкового синтеза и, вообще говоря, представляет собой регулируемый процесс.
Запас генов для производства ферментов в бактериальной клетке очень велик. Клетке, получающей углерод только от глюкозы, нужно около 800 различных ферментов, тогда как хромосома (бактерии кишечной палочки) способна кодировать до 4000 различных полипептидных цепей (Уотсон).
Клетка имеет широкие возможности для запуска производств различных клеток и белковых катализаторов. Относительно некоторых ферментов мы уже сейчас имеем сведения, сколько примерно молекул данного белки находится в одной клетке. Так, каждая клетка кишечной палочки, растущей в среде лактозы, имеет около 3000 молекул фермента галактозидазы, что составляет примерно 3% от всего клеточного белка.
Количество белка может изменяться в зависимости от состава среды, в которой живет клетка, хотя некоторые ферменты (конститутивные) всегда присутствуют в сравнительно больших количествах. Они выполняют особо важные функции: синтезируют АТФ, нуклеотиды осуществляют процессы, связанные с начальными стадиями разложения глюкозы, и т. д.
Статья на тему Ферменты

Добавить комментарий
Для отправки комментария вам необходимо авторизоваться.