Цинкование
В производстве существует два типа цинкования, горячий и электролитический.
Горячий метод заключается в погружении в расплавленный цинк железа, но большой недостаток такого метода, что листы под воздействием температуры деформируются и используют электролитический.
Электролитическое цинкование применяется для нанесение металла на любую железную поверхность которую нужно защитить от воздействия окружающей среды.
В лабораторных условия нанесения цинка производиться аналогично электролитического, но в качестве электролита используют ZnSO4•7H2O он менее токсичен чем цианисто цинковые.
Цинкование применяется для защиты черных металлов от коррозии. Осадок цинка с течением времени заметно темнеет, так как покрывается с поверхности слоем основных карбонатов.
Этим объясняется непригодность цинка в качестве декоративного покрытия. Цинк имеет более отрицательный потенциал, чем железо (φ°Zn/Zn2+ =—0,76 в), поэтому цинковое покрытие обеспечивает электрохимическую защиту черных металлов от коррозии. Скорость коррозии цинковых покрытий зависит от условий их эксплуатации.
Так, по данным в средних широтах скорость коррозии цинкового покрытия составляет около 0,5—0,6 мк в год для сельской местности и 3,6 мк для промышленного района с атмосферой, загрязненной SO2, SO3, СО2 и другими активными агентами. В условиях высокой влажности воздуха при значительных колебаниях температуры с обильным выпадением росы (в тропических широтах) скорость коррозии сильно возрастает, и применение цинковых покрытий нецелесообразно. Морская вода также быстро разрушает цинковое покрытие.
В настоящее время нанесение цинка на изделия из черных металлов производится преимущественно горячим способом или электролитически.
Горячий способ цинкования заключается в кратковременном погружении предварительно подготовленных изделий в расплавленный цинк при 450—480° С. Образование покрытия основано на хорошем смачивании железа цинком. Во избежание окисления, поверхность расплавленного цинка покрывают слоем флюса из хлоридов цинка и аммония. Толщина покрытия, вследствие наплывов цинка на отдельных участках поверхности, колеблется в значительных пределах (50—150 мк) и точное регулирование ее невозможно. Из-за этого горячий способ не может быть применен для изделий с точными размерами и в тех случаях, когда высокая температура процесса может изменить их механические свойства. Этот метод весьма широко применяется для цинкования предметов, имеющих внутренние закатанные швы (ведра, тазы, баки и пр.). При этом одновременно с защитой от коррозии происходит уплотнение швов. Горячий способ применяют также при цинковании труб и листов.
Цинкование электролитическим методом является более совершенным способом нанесения цинка. Экономия металла при гальваническом способе по сравнению с горячим достигает 50%, а высокая степень чистоты осажденного цинка обеспечивает повышенную химическую стойкость покрытия. Толщина цинковых покрытий в зависимости от условий службы обычно колеблется от 7 до 50 мк.
Кадмиевое покрытие, так же как и цинковое, применяется главным образом для защиты черных металлов от коррозии. Однако, если цинковое покрытие почти при всех условиях является анодным, то кадмиевое покрытие в одних условиях может быть анодным, а в других — катодным. В растворах, содержащих хлориды, кадмий является анодом по отношению к железу. Поэтому кадмиевые покрытия могут применяться для защиты изделий, работающих в морских условиях. Этому благоприятствует также и то обстоятельство, что кадмий химически устойчивее цинка.
Высокая пластичность кадмиевого покрытия используется при покрытии резьбовых деталей; этим обеспечивается герметичность резьбовых соединений.
Тем не менее кадмиевые покрытия имеют ограниченное применение из-за значительной стоимости и дефицитности самого кадмия.
Цинкование сернокислыми цинковыми электролитами
Zn2+ + 2e→ Zn
Перенапряжение водорода на цинке большое, поэтому металл выделяется на катоде с высоким выходом по току.
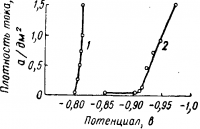
Рис. 2. Катодная поляризация в цинковых сернокислых электролитах.
Основной компонент цинковых сернокислых электролитов — ZnSO4 • 7Н2О. Растворимость этой соли в воде составляет при 25° С 36,3 вес. %.
Электропроводность растворов сульфата цинка невелика и для ее повышения в электролит вводят «проводящие» соли, например, Na2SO4 • 10Н2О; такие добавки, кроме того, увеличивают катодную поляризацию, способствуя улучшению рассеивающей способности электролита.
Хорошие цинковые покрытия получаются при значениях рН = 3,5—4,5. Более высокая кислотность вызывает повышенный расход анодов и накопление цинка в растворе; при низкой кислотности (рН>4,5) возникает опасность выпадения гидроокиси цинка, что приводит к образованию грубого катодного осадка. С целью стабилизации величины рН в электролит вводится добавка Al2(SO4)3 • 18Н2O или KAl(SO4)2 • 12Н2O, гидролиз которых начинается при рН = 4,0—4,5.
Применение органических добавок (декстрина, лакрицы, дисульфонафталиновой кислоты) способствует повышению катодной поляризации, которая вообще незначительна (рис. 2) и увеличению рассеивающей способности электролита. Одновременно улучшается и структура осадков, приобретающих полублестящий серебристый оттенок.
Сернокислый электролит имеет следующий состав (в г/л):
ZnSO4•7H2O. . . 200—300
Na2SO4•10H2O . . . 50—100 Al2(SO4)3• 18H2O . . . 30
Декстрин . . . 8—10
Процесс ведут при температуре электролита 18—25° С и при рН = 3,5—4,5. Катодная плотность тока 2—5 а/дм2 и выход по току 95—98%. В качестве анодов применяют пластины из чистого металлического цинка (99,85÷99,90% Zn). Анодный процесс растворения цинка протекает без затруднений с выходом по току ~ 100%.
Рассеивающая способность кислых электролитов невелика. Это связано, как уже отмечалось, с незначительной поляризуемостью катода и практической независимостью выхода по току от плотности тока. Поэтому сернокислые электролиты применяются для покрытия изделий простой формы: листов, лент, проволоки и т. п.
На конвейерных установках для оцинковки проволоки и ленты, благодаря их непрерывному движению в электролите, удается, применять значительно более высокие плотности тока (до 400 а/дм2). Концентрацию сульфата цинка при этом максимально повышают и резко сокращают содержание проводящих солей.
Цианистые цинковые электролиты
Zn (ОН)2 + 2NaCN → Zn (CN)2 + 2NaOH Zn(CN)2+2NaCN → Na2 [Zn (CN)4]
Диссоциация Na2[Zn(CN)4] протекает по следующей схеме:
Na2 [Zn (CN)4] → 2Na+ + [Zn (CN)4]2-[Zn (CN)4]2- → Zn2+ + 4CN-
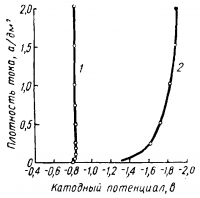
Вследствие довольно большой прочности комплексного аниона [Zn(CN)4]2- (КН—1,3 • 10-17) активность ионов цинка ничтожно мала и потенциал выделения цинка сильно сдвинут в область отрицательных значений. На рис. 3 показаны поляризационные кривые при выделении цинка из кислых и цианистых растворов.
Рис. 3. Катодная поляризация в цинковых сернокислых и цианистых электролитах:
1 — 3 н. раствор ZnSО4; 2 — 1 н. раствор Zn (CN)2+4,3 н. раствор NaCN.
Как это видно из рис. 3, в цианистом электролите катодная поляризация увеличивается с повышением плотности тока в большей степени, чем в кислом электролите. Низкая концентрация ионов цинка и относительно высокая катодная поляризация в цианистом электролите обусловливают более низкий выход по току, который падает с повышением плотности тока. Вследствие этого допустимый предел плотности тока в цианистых электролитах ниже, чем в кислых.
Вместе с тем представления о разряде простых ионов в комплексных электролитах встречают серьезные возражения. Расчет показывает, что число простых ионов в некоторых цианистых электролитах должно быть исчезающее малым. По-видимому, в этом случае происходит непосредственный разряд адсорбированных комплексных анионов. Однако для простоты и удобства в дальнейшем мы будем пользоваться схемой, по которой выделение металла происходит в результате разряда простых ионов, образующихся при диссоциации комплексных ионов.
В состав цианистых электролитов вводят едкую щелочь, образующую хорошо растворимые цинкаты. Добавка щелочи позволяет сократить количество цианидов.
Для приготовления цианистого электролита берут следующие компоненты (в г/л):
ZnO ……. 40
NaCN…….85÷120
NaOH …….40÷60
Электролиз ведут при 18—40° С. Катодная плотность тока составляет 1—4 а/дм2. Выход по току 70—80%.
Кроме указанных основных компонентов, в цианистых электролитах всегда содержится некоторое количество карбонатов натрия или калия, образующихся за счет взаимодействия углекислого газа воздуха с едкой щелочью и цианидами.
Если в электролите мало щелочи, то протекает реакция с образованием синильной кислоты:
2NaCN + СО2 + Н2О → Na2CO3+2HCN
Синильная кислота подвергается гидролизу с образованием муравьиной кислоты:
HCN+2H2О→ HCOOH + NH3
В присутствии значительных количеств щелочи синильная кислота не образуется:
2NaCN + 2H2О+2NaOH+О2 → 2Na2CО3+2NH3
Таким образом, содержание цианида натрия в процессе электролиза уменьшается и требуется периодическая корректировка. Синильная кислота — один из наиболее сильных ядов, поэтому необходима надежная бортовая вентиляция.
Для улучшения внешнего вида осадка цинка в электролит добавляют глицерин, сульфид и гипосульфит натрия в количестве 2—3 г/л и некоторые другие химические соединения.
Высокая поляризуемость, а также снижение выхода по току с повышением плотности тока благоприятствуют высокой рассеивающей способности цианистого электролита. Поэтому цианистые электролиты применяются для покрытия изделий, имеющих сложную форму. Следует, однако, иметь в виду, что этот электролит, как и все другие цианистые электролиты, очень токсичен и обращение с ним требует особых мер предосторожности.
Анодный процесс в цианистом цинковом электролите протекает без особых затруднений. При электролизе с высокой анодной плотностью тока может наступить пассивирование анодов из-за пленки не растворившихся солей. Склонность к пассивированию анодов проявляется особенно сильно при недостатке в электролите цианида. При высоком содержании едкой щелочи наблюдается неравномерное разъедание анодов.
Цинкатные электролиты
Цинкатные электролиты содержат в основном два компонента: цинкат натрия Na2ZnО2 и едкий натр NaOH.
Выделение цинка на катоде происходит в результате разряда ионов цинка Zn2+ по схеме:
Na2ZnО2 → 2Na+ + ZnO2-2
ZnO2-2 +Н2О → Zn2+ +4ОН—
Zn2+ + 2e → Zn
Катодная поляризация в цинкатных электролитах сравнительно невелика, что может быть объяснено меньшей прочностью комплексного иона ZnО2-2 по сравнению с прочностью иона [Zn(CN)4]2-. Цинкатный электролит допускает работу лишь при невысоких плотностях тока и склонен давать губчатые и дендритные осадки.
По данным Н. Т. Кудрявцева, образование губки и дендритов можно предотвратить путем введения в электролит незначительных количеств олова, ртути или свинца.
Температура 45—55° С Катодная плотность тока 0,5—1,2 а/дм2. Выход по току 96—98%. При перемешивании электролита плотность тока может быть поднята до 2,5—3,0 а/дм2.
Цинкатные электролиты для цнкования не ядовиты и обладают довольно хорошей рассеивающей способностью, приближающейся к рассеивающей способности цианистых электролитов, поэтому применение их особенно целесообразно как заменителей токсичных цианистых электролитов. В промышленности используют также комбинированные цинкатно-цианистые электролиты.
Аммиакатные электролиты для цинкования
Аммиакатные электролиты, предложенные впервые С. Я. Поповым. Цинк в растворах, содержащих аммонийные соли, может давать комплексные ионы с различным координационным числом. В щелочных растворах цинка даже при наличии достаточного количества солей аммония возможно существование цинкатных ионов типа [Zn(OH)4]2-. В слабощелочной среде образуются аммиакаты цинка с координационным числом 4 и 6, например
[Zn(NH3)4]2+.
При понижении рН раствора происходит отщепление молекул аммиака, координационное число уменьшается до 2 и образуется ион [Zn(NH3)2]2+.
Дальнейшее понижение рН раствора приводит к постепенному разрушению и этого иона до обычного иона цинка. При составлении электролита из простых солей цинка или из его окиси при воздействии солей аммония или гидроокиси аммония могут протекать следующие реакции:
ZnSО4 + 4NH4OH → [Zn (NH3)4]SO4 + 4H2O ZnO + 2NH4Cl → [Zn (NH3)2]Cl2 + H2O
В практике предпочтение отдают хлористоаммониевым электролитам, которые более устойчивы по сравнению с сульфатноаммониевыми электролитами благодаря меньшей летучести аммиака в них.
Для использования в стационарных ваннах может быть рекомендован электролит, работающий в щелочной области:
ZnO — 30—50
NH4Cl — 270—300
Клей мездровый — 2—4
Электролит работает при рН = 7,2—7,5Л, Катодная плотность тока 1,5 а/дм2, температура 18—25° С. Катодный и анодный выходы по току близки к 100%. Используют цинковые аноды. Рассеивающая способность электролита почти не уступает цианистому. Для барабанных и колокольных ванн применяется хлористоаммониевый электролит того же состава, но работающий при рН = 5,5. Преимуществом этого электролита является незначительное улетучивание аммиака. Это позволяет работать при повышенных температурах и в условиях сильного перемешивания.
Необходимо отметить возможность использования в практике электролитов на основе аминов (этилендиаминовые и этаноламиновые комплексы), однако они еще не получили широкого применения.
Для повышения коррозионной устойчивости цинковых покрытий применяют пассивирование их в растворах хромовой кислоты или ее солей. Образующаяся хроматная пленка содержит ряд соединений хрома и цинка: Сr(ОН)3, Cr(OH)CrO4, ZnCrO4 и др. Цинковое покрытие, обработанное этим раствором, приобретает зеленовато-желтую окраску с радужным оттенком.
Статья на тему Цинкование


Добавить комментарий
Для отправки комментария вам необходимо авторизоваться.