Химические источники электрической энергии
Примером подобного устройства может служить медно-цинковый источник электрической энергии, предложенный Даниелем и Якоби в 1836 г. Медь, погруженная в раствор медного купороса, отделена диафрагмой от цинка, погруженного в раствор цинкового купороса:
Cu|CuSО4| |ZnSО4| Zn
При работе элемента цинк переходит в раствор, отдавая электроны: Zn → Zn2+ + 2e. Электроны по внешней цепи проходят к меди, на медном электроде из раствора выделяется медь: Cu2+ + 2e → Сu. Поток электронов, т. е. электрический ток во внешней цепи, может быть использован для работы, что и является целью применения ХИЭЭ. На цинковом электроде происходит реакция окисления, а на медном — реакция восстановления. Цинковый электрод несет отрицательный заряд, а медь — положительный. Химическая реакция, протекающая в медно-цинковом элементе, может быть записана следующим образом:
CuSO4 + Zn → ZnSO4 + Cu
В электротехнике условно принято считать направление электрического тока обратным направлению движения электронов во внешней цепи (рис 2, а). Анодом служит электрод, на котором идет окислительный процесс, катодом — электрод, на котором идет восстановление.
Для регенерации активных веществ можно после работы медно-цинкового элемента подвести к нему ток от внешнего источника электрической энергии. Направления движения ионов и электронов станут обратными (рис. 2,6). Следует отметить, что хотя окислительный и восстановительный процессы поменяются местами, знак заряда электродов сохранится (медь — плюс; цинк — минус).
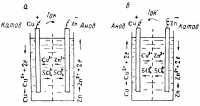
Рис. 2. Схема движения ионов и электронов при работе медно цинкового элемента.
При работе элемента Даниеля — Якоби количество энергии, переходящей в электрическую, меньше величины теплового эффекта реакции. Элемент разогревается, и часть энергии теряется. Температурный коэффициент элемента Даниеля — Якоби равен —3,59 • 10-4 в/град. Тепловой эффект реакции
Zn + CuSО4 → ZnSО4 + Cu
равен ∆Н = —55 189 кал.
Известны элементы, у которых температурный коэффициент положителен, при работе они охлаждаются и поглощают тепло из внешней среды. Получаемое в них количество электрической энергии больше, чем соответствует расчету по формуле Томсона.
Химические источники электрической энергии бывают одноразового и многократного действия. ХИЭЭ одноразового использования называются первичными элементами, а многократного действия вторичными элементами или аккумуляторами. Иногда первичные элементы называют просто «элементами» или «гальваническими элементами». Аккумуляторами могут служить только такие химические источники электрической энергии, основные процессы в которых протекают обратимо.
Вещества, израсходованные в процессе протекания реакции, дающей электрическую энергию, должны регенерироваться при пропускании через разряженный аккумулятор электрического тока от постороннего источника электрической энергии. Направление тока внутри аккумулятора при заряде будет обратным имевшемуся при разряде, на отрицательном электроде реакция окисления заменяется реакцией восстановления, а на положительном электроде реакция восстановления заменяется реакцией окисления. Таким образом, в аккумуляторах запас химической энергии, истраченной на получение электрической энергии при разряде, возобновляется при заряде.
Так как напряжение одного отдельного первичного элемента или аккумулятора очень невелико— они в большинстве случаев применяются последовательно соединенными по несколько штук. В таком виде ХИЭЭ называют «батареей».
Электродвижущая сила и напряжение при разряде
Основной характеристикой химических источников электроэнергии является их электродвижущая сила, т. е. разность потенциалов электродов, измеренная при отсутствии тока во внешней цепи.
Для практики более важной величиной, чем э. д. с, является напряжение химического источника электрической энергии при замкнутой внешней цепи.
Напряжение при разряде меньше э. д. с. по двум причинам: во первых, потенциалы электродов при отборе тока .от ХИЭЭ заметно отличаются от тех, которые имеют место при разомкнутой внешней цепи и во-вторых, часть э. д. с. теряется на преодоление внутреннего сопротивления элемента. Это можно выразить формулой:
V = φ‘a — φ‘к — Ir = IR
где φ‘a, φ‘к— потенциалы электродов при отборе тока; I — ток разряда; r — внутреннее омическое сопротивление ХИЭЭ; R — внешнее сопротивление (нагрузка) при разряде.
Потенциалы электродов при работе химического источника электрической энергии (разряде или заряде) отличаются от потенциалов, измеренных при разомкнутой внешней цепи, на величину, называемую э. д. с. поляризации:
φa — φк — (φ‘a — φ‘) = Епол
где Епол — э. д. с. поляризации.
Внутреннее сопротивление ХИЭЭ
Напряжение при разряде (заряде), кроме поляризации электродов, зависит также от падения напряжения на преодоление внутреннего омического сопротивления ХИЭЭ. Последняя величина слагается из омического сопротивления проводников первого рода (электродов), электросопротивления электролита и сепараторов. При разряде малыми плотностями тока падение напряжения внутри ХИЭЭ не имеет значения, но при больших плотностях тока оно может оказаться заметным. Например, в свинцовом автомобильном аккумуляторе омическое сопротивление электролита и сепараторов при комнатной температуре приблизительно равно 0,006 ом на 1дм2 площади электродов. При плотности тока разряда 12 а/дм2 падение напряжения составит около 70 мв, т. е. около 3,5% от э. д. с. аккумулятора.
На практике часто представляет интерес произвести приближенные расчеты напряжения при разряде в зависимости от нагрузки ХИЭЭ. Пользуются иногда условной величиной внутреннего сопротивления ХИЭЭ, характеризующей разницу между э. д. с. и напряжением при разряде, происходящую как от поляризации, так и от падения напряжения на преодоление внутреннего омического сопротивления. Тогда:
V = E — IR
где V — напряжение, в; Е — электродвижущая сила, в; I— ток разряда, a; R — условное внутреннее сопротивление ХИЭЭ.
Величина К является грубо приближенной, так как омическая составляющая условного внутреннего сопротивления не зависит от нагрузки, а поляризация резко меняется при изменении плотности тока разряда. Величину К находят, производя несколько кратковременных разрядов ХИЭЭ различными токами и принимая среднюю величину. Внутреннее омическое сопротивление ХИЭЭ в принципе можно определить путем замеров переменным током, но, так как эта величина очень мала, результаты получаются ненадежными.
Для вычисления К существуют эмпирические формулы, однако они дают удовлетворительные результаты только в частных случаях. При точных расчетах пользоваться величиной К не рекомендуется, а необходимо произвести экспериментальное определение величины напряжения в зависимости от нагрузки ХИЭЭ.
Емкость и энергия ХИЭЭ
Емкостью ХИЭЭ называют количество электричества, которое можно от него отобрать при разряде в определенных условиях. Для аккумуляторов различают емкость при разряде и при заряде. Емкостью при заряде называют количество электричества, которое требуется израсходовать при заряде аккумулятора в данных условиях.
Емкость при заряде, как правило, больше емкости при разряде, так как часть тока заряда теряется на побочные процессы. Емкость ХИЭЭ зависит от количества заложенных в них активных веществ и степени их использования. Использование активных материалов обычно тем лучше, чем ниже плотность тока разряда и чем выше температура. Повышение температуры имеет некоторый предел, выше которого нормальному использованию ХИЭЭ препятствуют усиливающиеся побочные процессы.
Энергия ХИЭЭ выражается произведением его емкости на среднее напряжение.
Для аккумуляторов отдачей по энергии η называют отношение энергии, отданной при разряде, к энергии, полученной при заряде.
Для сравнения различных типов ХИЭЭ пользуются удельными величинами: емкостью, энергией или мощностью, отнесенными к единице веса или объема ХИЭЭ.
Саморазряд и сохранность ХИЭЭ
Активные материалы ХИЭЭ частично расходуются и на бесполезные побочные процессы. К таким процессам относятся, например, утечки тока через случайные замыкания в ХИЭЭ, растворение электродов в элекролите и др.
Потери емкости, происходящие из-за вредных побочных процесс сов, называются саморазрядом, имеются некоторые специальные конструкции элементов, у которых саморазряд настолько велик, что электролит в них приходится заливать только перед самым началом работы. Например, в свинцово-цинковом элементе, приводимом в действие путем заполнения раствором серной кислоты, бесполезно теряется при разряде 10—30% цинка, растворяющегося в серной кислоте с выделением водорода. Сохранность ХИЭЭ тесно связана с их саморазрядом. Сохранностью называют время, в течение которого ХИЭЭ годен к употреблению, т. е. сохраняет определенный запас электрической энергии.
Для аккумуляторов, кроме сохранности, важной характеристикой является также срок службы. Срок службы выражают либо во времени, в течение которого аккумулятор пригоден для разрядов и зарядов, либо в числе циклов заряда и разряда, в течение которых аккумулятор способен отдавать емкость не ниже предусмотренной для данного типа.
Применение химических источников электрической энергии и требования, предъявляемые к ним
Химические источники электрической энергии в настоящее время широко применяют в промышленности и быту. Это вызвано тем, что большое количество современных машин и аппаратов нуждается в автономных источниках электрической энергии, не связанных с неподвижными электрическими станциями.
Для промышленного применения ХИЭЭ должны обладать рядом свойств, редко встречающихся одновременно в одной системе. ХИЭЭ должны отвечать следующим требованиям:
1) иметь возможно большую э. д. с;
2) отдавать большие токи без резкого падения э. д. с, т. е. не сильно поляризоваться в процессе работы;
3) активные вещества должны иметь возможно малый эквивалентный вес и высокую степень использования;
4) обладать малым саморазрядом, хорошей сохранностью;
5) производство ХИЭЭ должно быть технологичным и доступным по цене.
Аккумуляторы, кроме того, должны иметь высокую отдачу по энергии и большой срок службы.
Выбор электрохимических систем для ХИЭЭ
Для получения ХИЭЭ с наибольшей э. д. с. следовало бы взять электроды, наиболее далеко отстоящие друг от друга в таблице стандартных потенциалов.
Очень высокой э. д. с. обладал бы элемент с электродами, изготовленными из лития и фтора, но осуществить его невозможно, так как эти вещества мгновенно вступают в реакции с водными растворами и водой.
В качестве материала для отрицательного электрода все щелочные металлы в чистом виде применить крайне трудно, так как они слишком энергично реагируют с водными растворами. При приведении в соприкосновение электродов из щелочных металлов с электролитом весь материал расходуется на химическую реакцию настолько быстро (со взрывом), что не удается отобрать во внешнюю цепь существенное количество электричества.
При замене водных растворов электролитов на неводные реакции щелочных металлов с электролитом замедляется, но соответственно снижается и электродный потенциал. Попытки использовать для отрицательного электрода магний или алюминий затруднены тем, что эти металлы находятся либо в пассивном состоянии и имеют потенциал значительно более положительный, чем соответствует стандартных потенциалов, либо при активации начинают слишком бурно реагировать с электролитом. Первичные элементы с электродами из магния все же удалось осуществить.
Наиболее распространены первичные элементы с отрицательным электродом из цинка. Применение цинка объясняется тем, что он не сильно поляризуется, дает хороший коэффициент использования металла и хорошо сохраняется.
Статья на тему Химические источники электрической энергии


Добавить комментарий
Для отправки комментария вам необходимо авторизоваться.