Выщелачивание руд меди
Окисленные медные руды плохо подвергаются обогащению, поэтому их перерабатывают преимущественно гидрометаллургическими способами. Гидрометаллургические методы в металлургии меди находят также широкое применение для смешанных окисленно-сульфидных руд, при извлечении меди из рудничных отвалов, «хвостов» обогатительных фабрик и рудничных вод.
Общая схема гидрометаллургической переработки сырья состоит из трех основных операций: выщелачивания, подготовки растворов и экстракции металла из раствора. Цель выщелачивания — перевод извлекаемого металла в раствор путем обработки исходной руды тем или иным растворителем, способным достаточно полно растворять только этот металл.
В качестве растворителей при выщелачивании медьсодержащего сырья применяю разбавленную серную кислоту или подкисленные серной кислотой растворы сульфата окиси железа, а также аммиачные растворы.
Выщелачивание разбавленной серной кислотой. Разбавленная серная кислота хорошо растворяет почти все природные окисленные соединения меди (закись меди Cu2О и самородную медь растворяет только в присутствии кислорода воздуха).
Помимо соединении меди, серная кислота при обработке ею массы руды растворяет и некоторые породообразующие минералы. К ним относятся, в первую очередь, гидраты окиси железа общей формулы Fe2О3 • /nН2О.
Интенсивное растворение железа увеличивает расход серной кислоты. К бесполезному расходу серной кислоты приводит также содержание в исходной руде карбонатов и основных солей кальция, магния, железа и др.
Следовательно, выщелачиванию серной кислотой подлежат только руды окисленной меди, не содержащие в значительных количествах растворимых в серной кислоте соединений трехвалентного железа, карбонатов и основных солей.
Разбавленная серная кислота не действует на сульфидные соединения меди, поэтому прямое сернокислотное выщелачивание руды, содержащей значительное количество медных сульфидных минералов, невыгодно.
Выщелачивание растворами Fe2(SО4)3. Сульфат железа является растворителем для сульфидных минералов меди. При этом наиболее хорошо растворяются в сульфате так называемые вторичные сульфиды (CuS, Cu2S):
CuS + Fe2(SO4)3 → CuSO4+2FeSO4 + S
Cu2S+2Fe2(SO4)3 → 2CuSO4 + 4FeSO4 + S
В нейтральных растворах сульфат окиси железа легко гидролизуется с выпадением в осадок гидрата или основных солей окиси железа. Чтобы воспрепятствовать этому, растворы сульфата окиси железа всегда подкисляют серной кислотой, и при этом растворяющее действие на руду оказывает уже не только сульфат, но и кислота.
Подготовка растворов меди к электролизу
Цементация железом применяется в основном для экстракции меди из бедных или сильно загрязненных растворов сернокислотного выщелачивания.
Электролиз с нерастворимыми анодами является основным методом экстракции меди, который применяют на большинстве заводов, перерабатывающих руду гидрометаллургическим способом.
Растворы, получающиеся при выщелачивании, содержат всегда целый ряд примесей (железо, хлор-ион, мышьяк, алюминий и пр.). Некоторые из них отрицательно влияют на дальнейший процесс электроэкстракции, поэтому они должны быть либо удалены, либо обезврежены.
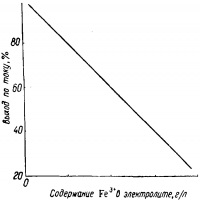
Вредное действие железа заключается в том, что при электролизе ионы Fe2+ окисляются у анода в ионы Fe3+, последние восстанавливаются у катода обратно в двухвалентные, вызывав тем более значительное снижение выхода по току, чем выше концентрация ионов железа в электролите (рис.1).
Ликвидировать вредное действие железа можно, удалив его из раствора. Для этого раствор иногда обрабатывают дробленым известняком, который вначале нейтрализует свободную серную кислоту
CaCО3 + H2SО4 → CaSО4 + CО2 + H2О
а затем взаимодействует с сульфатом железа
Fe2 (SО4)3 + ЗСаСО3+ЗН2О → 2Fe (ОН)3 + 3CaSО4 + 3CО2
Закисное железо предварительно окисляют в окисное пиролюзитом МnО2 или кислородом воздуха. Окисление проводят в чанах с мешалками.
Одновременно известняк осаждает также в виде труднорастворимых соединений часть алюминия, большую часть мышьяка и фосфора. Обработка растворов известняком может полностью очистить электролит от железа и большей части других примесей, но одновременно ведет к осаждению некоторого количества меди и к безвозвратным потерям серной кислоты в виде CaSO4, и поэтому применяется редко.
Однако чаще всего вредное действие железа уничтожают восстановлением окисного железа до закисного. Наличие в электролизере только одного закисного железа устраняет реакции химического растворения катодной меди и катодного восстановления железа. Снижение в этом случае выхода по току происходит только за счет обратного восстановления окисного железа, образовавшегося непосредственно в ванне на аноде. Этому стремятся воспрепятствовать, проводя электролиз с очень высокой скоростью циркуляции электролита.
Наиболее распространенным способом восстановления ионов Fe3+ является обработка раствора цементной медью
Fe2 (SО4)3 + Сu → 2FeSО4 + CuSО4
приводящая также к удалению ионов Сl— из электролита в виде труднорастворимой полухлористой меди:
CuCl2 + Cu → 2CuCl
Рис. 1. Зависимость выхода меди по току от содержания в электролите ионов Fe3+.
Вредное действие иона NO3—, так же как и иона Сl—, проявляется в разрушающем действии на свинцовые аноды. Способов
удаления иона NO3— из раствора не существует. При наличии его обычные свинцовые аноды приходится заменять анодами, отлитыми из кремнистого сплава «Чилекс» (53% Сu, 23% Fe, 23% Si) или из плавленого магнетита.
Электролиз меди с нерастворимыми анодами
Катодный процесс при электроэкстракции меди существенно не отличается от катодного процесса при электролитическом рафинировании меди и состоит почти исключительно в разряде ионов Сu2+.
Особенностью катодного процесса является большая величина катодной поляризации вследствие низкого содержания ионов Сu2+ в электролите. В результате, при глубоком удалении меди из раствора начинается с выделение водорода и ухудшается качество катодного осадка: он становится рыхлым. Поэтому приходится, во-первых, экстрагировать медь далеко не полностью, чтобы не допустить чрезмерного обеднения электролита в целом, и, во-вторых, применять весьма интенсивное перемешивание, чтобы предотвратить местное обеднение раствора у катода.
Анодный процесс при электроэкстракции совершенно иной, чем при электролитическом рафинировании — он проводится с нерастворимыми (преимущественно свинцовыми) анодами.
На свинцовом аноде возможны следующие реакции (кроме окисления Fe2+):
Рb — 2е → Рb2+
2Н2O — 4е → 4Н++O2
В первую очередь должна идти реакция растворения металлического свинца, как обладающая наиболее отрицательным равновесным потенциалом (стандартный потенциал φРb/Рb2+ = — 0,13 в).
Это в действительности и наблюдается в первый момент электролиза с новыми свинцовыми анодами. Однако перешедшие в раствор ионы Рb2+ образуют с ионами SO2-4 нерастворимый сульфат свинца PbSO4, который отлагается на поверхности анода. Пленка PbSO4, будучи непроводником, вызывает местную солевую пассивацию анода; поэтому на свободных еще участках поверхности анода резко возрастает плотность тока, обусловливая поляризацию, приводящую к возрастанию анодного потенциала.
Увеличение потенциала анода и наличие около анода в растворе ионов Рb2+ делает возможным протекание еще одной окислительной реакции, равновесный потенциал которой более положителен, чем потенциал растворения анода, но более отрицателен, чем потенциал выделения кислорода, а именно процесса окисления двухвалентного свинца в четырехвалентный:
Pb2+—2e → Pb4+
Образующийся при этом в первый момент сульфат четырехвалентного свинца гидролизуется
Pb(SO4)2+2H2О ⇄ РbO2+2Н2SO4
образуя двуокись свинца.
Двуокись свинца, в свою очередь, отлагается на аноде в порах защитной пленки PbSO4, образуя прочный проводящий слой, препятствующий дальнейшему растворению анода. Вследствие этого потенциал анода еще более возрастает и достигает, наконец, потенциала выделения кислорода. С этого момента процесс выделения кислорода становится доминирующим.
Таким образом, химическая реакция, протекающая в ванне для электроэкстракции меди, аналогична реакции в регенерационной ванне:
CuSO4 + H2O → Cu + H2SO4 + 0,5O2
Теоретическое напряжение разложения для этой реакции дает величину 0,89 в. Практически, благодаря катодной поляризации, значительному кислородному перенапряжению и падению напряжения в электролите, напряжение на ванне составляет 1,8—2,0 в.
Для получения приемлемых катодного выхода по току и напряжения на ванне растворы, идущие на электролиз, должны содержать не менее 20 г/л Сu и 25—35 г/л свободной H2SO4. Если при выщелачивании получаются более бедные по меди растворы, то их перерабатывают цементацией. После выщелачивания содержание серной кислоты в богатом медью растворе обычно очень низкое, он почти нейтрален. Чтобы довести кислотность электролита до оптимальной, в него добавляют чистую серную кислоту или отработанный электролит, имеющий повышенную кислотность.
В отличие от процесса рафинирования меди температурный режим процесса электроэкстракции специально не регулируется. Поступающий в ванну электролит имеет температуру окружающей среды, отработанный раствор имеет обычно температуру на 5—10град выше.
Скорость циркуляции электролита поддерживают всегда, как указывалось, очень высокой. Это приводит к тому, что в обычного размера ваннах при однокаскадной системе электролит не успевает обезмеживаться. Чтобы довести извлечение меди до нужной величины, применяют многокаскадную систему циркуляции и вытянутые по длине ванны. При этом состав электролита в разных ваннах каскада оказывается неодинаков. В наиболее тяжелых условиях работы находятся последние ванны в каскаде. В последней ванне концентрация меди обычно 12—15 г/л. Пройдя через каскад ванн, отработанный электролит, обогащенный серной кислотой, поступает на выщелачивание руды и вновь возвращается на электролиз. В процессе многократного оборачивания электролит постепенно обогащается растворенными при выщелачивании примесями, не удаляющимися в ходе обычной очистки. Поэтому часть циркулирующего электролита следует выводить из цикла. Основной примесью, определяющей отбор электролита, является железо. Содержание его в растворе допускается до 4—5 г/л.
Из отобранного электролита медь извлекают цементацией железом.
Ванны для электролиза с нерастворимыми анодами изготовляют преимущественно из железобетона, футеруют кислотоупорным асфальтом или рольным свинцом. Размеры ванн колеблются в широких пределах; обычно они имеют большую длину (до 20м).
Расстояние между анодами составляет 90—100 мм. Аноды изготовляют из свинца с добавкой сурьмы (6%), придающей им большую прочность и стойкость, или из сплава «Чилекс», реже магнетитовые. Свинцовые аноды делают сплошными или решетчатыми, в последнем случае уменьшается расход металла на изготовление анода, но возрастает анодная плотность тока, а следовательно, и расход электроэнергии. Расход анодов при электролизе составляет 0,4—1,0% от веса катодной меди.
Катодными основами служат медные листы, которые получают в ваннах с растворимыми анодами. Длительность наращивания катодов колеблется от 5 до 14 дней.
Статья на тему Выщелачивание меди


Добавить комментарий
Для отправки комментария вам необходимо авторизоваться.