Термическое получение магния
Во время второй мировой войны в ряде стран применяли два термических способа получения магния — углетермический и силикотермический.
Углетермический способ получения магния
Восстановление окиси магния углеродом можно представить уравнением
MgO + С ⇄ Mg + СО
причем равновесие в этой реакции определяется равенством давлений диссоциации
рО2(MgO) = рО2(СO)
и давлением паров магния.
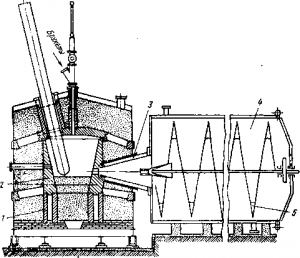
Рис. Дуговая печь для восстановления магния
Смещение реакции вправо, т. е. восстановление, станет возможным, если давление диссоциации окиси магния будет больше, чем давление диссоциации окиси углерода, в противном случае будет происходить окисление магния. Как следует из предыдущих глав, аналогичным путем получают никель, свинец, олово и т. д. Эти металлы обладают сравнительно небольшим сродством к кислороду и поэтому их окислы восстанавливаются углеродом при температурах, лежащих ниже точки их кипения.
Окиси легких, металлов (алюминия, магния и т. д.) имеют большое сродство к кислороду и поэтому они могут восстанавливаться углеродом только при очень высоких температурах, обычно превышающих точку кипения металла, и поэтому легкие металлы в момент восстановления находятся в парообразном состоянии.
Если металлы в процессе восстановления получаются в расплавленном или твердом виде, они быстро и легко отделяются от газообразных продуктов реакции, и обратное окисление при охлаждении вследствие небольшой поверхности и малого сродства к кислороду происходит в малой степени.
Если же металл в процессе восстановления получается в парообразном состоянии, его необходимо охладить ниже точки росы, чтобы отделить от окислов углерода.
При восстановлении окиси магния углеродом равновесная температура, ниже которой начинается реакция окисления паров магния, равна примерно 1900° С, а точка росы магния лежит значительно ниже 1000° С Таким образом, до того, как представится возможность разделить продукты реакции восстановления окиси магния углеродом, необходимо эти продукты, находящиеся в неравновесном состоянии, охладить более чем на 1000° С. Однако при температуре ниже 1900° С продукты начинают быстро взаимодействовать между собой и пары магния вновь окисляются окисью углерода.
Есть ряд приемов предотвращения обратного взаимодействия продуктов реакции, например разбавление их нейтральным газом, резкое охлаждение до температуры, при которой скорость взаимодействия продуктов реакции невелика, поглощение паров восстановленного металла каким-либо другим расплавленным металлом.
В практике углетермического способа получения магния применяют резкое охлаждение продуктов реакции.
Исследования показали, что магний и окись углерода заметно взаимодействуют лишь при температурах выше 300° С. Поэтому, если резко охладить продукты реакции до температуры ниже 250° С, то можно получить магниевый порошок, причем выход металлического магния при этом зависит от скорости охлаждения, которая исчисляется долями секунды.
Рассмотрим кратко технологию этого способа. Окись магния и нефтяной кокс дозируют и совместно размалывают. Молотую шихту брикетируют и подают в трехфазную дуговую печь мощностью 800 кВт (рис.). Восстановление протекает в атмосфере водорода, поэтому печь имеет герметичный стальной кожух с крышкой. Внутри кожуха нa угольных подставках 1 установлены угольные блоки 2, образующие рабочее пространство печи объемом около 4 м3. Через свод в печь вводят три графитовых электрода. Брикеты загружают через свод печи с помощью питателей и трубки из жаропрочной стали.
Ответственной деталью печи является конус охлаждения 3. Головка конуса должна находиться как можно ближе к рабочему пространству печи и поэтому ее изготовляют из жаропрочной стали. В головку конуса подают охлаждающую газовую смесь. В качестве газа-охладителя рекомендуется использовать тщательно очищенный водород либо природные горючие газы. Из конуса охлаждения газы, содержащие около 30 г/м3 пыли, поступают в холодильник 4 (диаметр 4,6 м, длина 10 м), снабженный водяной рубашкой. В нем оседает около 20% магниевой пыли и охлаждаются до 120° С газы. Удаление осевшей пыли из холодильников осуществляется с помощью шнека 5. Основная масса магниевой пыли уносится газами в теплообменник и затем после их охлаждения до 80° С улавливается в мешочных фильтрах. Пыль содержит приблизительно 50% Mg (металлического), 20% С и 30% MgO. Пыль брикетируют и путем сублимации из нее отгоняют металлический магний. Кристаллы сублимата магния затем переплавляют.
Чистота магния после переплавки составляет 99,97%. Общий расход энергии равен около 21 кВт•ч на 1 кг Mg.
Статья на тему Термическое получение магния

Добавить комментарий
Для отправки комментария вам необходимо авторизоваться.