Силикаты это наиболее многочисленный отдел минералов. Всего известно более 2000 видов минералов, причем на долю силикатов приходится не менее 600.
В количественном отношении силикаты составляют по весу не менее 85% всей земной коры.
Их образование идет преимущественно из магматических расплавов и, таким образом, генетически предшествует почти всем минералам.
Ими образовано огромное большинство горных повод, с которыми в свою очередь связано образование весьма Многих, притом практически чрезвычайно важных минералов, как руды черных и цветных металлов.
Что такое силикаты, структура, классификация
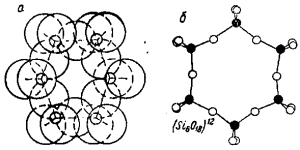
а- реальное взаимоотношение ионов; б- схема расположения центров ионов
Долгое время силикаты представляли собой наиболее сложную и трудно классифицируемую по химическому составу группу.
Нередко приходилось разделять—на основании чисто химических критериев — генетически неразделимые минералы, как, например, анортит (CaAl2Si2O8) и альбит (NaAlSi3O8).
С химической точки зрения они относятся к совершенно различным группам, а между тем в природе они абсолютно неразделимы, образуя непрерывный ряд плагиоклазов.
Можно привести и обратные примеры, когда на основании формально-химических признаков объединялись минералы, ничего общего по существу не имеющие.
Так, лейцит (KAlSi2O6) и эгирин (NaFeSi2O6) относились к группе метасиликатов, хотя трудно найти более яркий пример минералов, столь различных по всем своим свойствам.
Структурная систематика
Структурная (кристаллохимическая) систематика не только уничтожает приведенные противоречия, по и позволяет найти связь между составом, структурой и рядом физических свойств минералов.
Согласно современным воззрениям, общим структурным мотивом, входящим во все без исключения силикаты, является группировка, состоящая из четырех больших ионов кислорода (ионный радиус равен 1,34Å) и одного иона кремния (ионный радиус равен 0,39Å).
При этом центры ионов кислорода образуют четыре вершины тетраэдра, а ион кремния занимает центр такого тетраэдра (рис. 44).
Кремнекислородный тетраэдр обладает четырьмя свободными валентными связями, за счет которых и присоединяются ионы других элементов, скрепляя все соединения в прочную кристаллическую решетку.
Силикаты такого типа имеют характер ортосиликатов (по химической классификации).
Поскольку группы (SiО4) в них расположены изолированно относительно друг друга в кристаллохимической классификации, такие силикаты объединяются названием «островных» силикатов (например, оливин).
К этому же типу могут быть отнесены и такие силикаты, в состав которых входят сдвоенные кремне-кислородные тетраэдры, т. е. группы [Si2О7] (рис. 45).
Например каламин, или комбинированные соединения, в которых одновременно присутствуют и группировки SiО4 и Si2О7 (эпидот и др.).
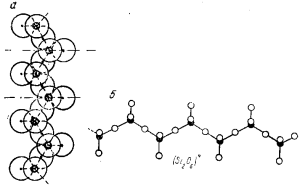
а — реальное взаимоотношение ионов; б—схема расположения центров ионов
Следует иметь в виду, что дальнейшее усложнение строения силикатов идет путем сцепления кремнекислородных тетраэдров в более сложные комплексы.
При этом тетраэдры соединяются исключительно через вершины, а отнюдь не по ребрам или гра-ням. Таким образом, два ближайших иона кремния соединяются только через один ион кислорода.
Такое построение (рис.) может дать или замкнутые кольца Si3О9, Si6O18 (волластонит, берилл), или перейти в бесконечные цепи с простейшим звеном [Si2О6] (диопсид) (рис. 2).
Первый тип можно назвать кольцевым, а второй — цепным.
Амфиболы
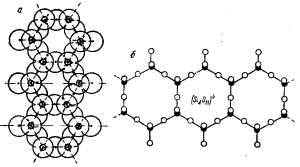
Усложнение цепного типа, через причленения к одной цепочке другой, приводит к образованию бесконечных лент с звеном [Si4O11] (рис. 3).
Такие силикаты называют ленточными (амфиболы). Присоединение лент в бесконечном количестве в одном слое создает слоевые силикаты. Их характеризует простейшая группа [Si4O10] (тальк, слюда).
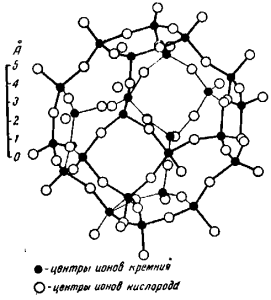
Наконец, пространственное сцепление кремнекислородных тетраэдров через все четыре вершины создает каркасы с группами [SiО2] (полевые шпаты, кварц). Один из вариантов каркаса изображен на рис. 4.
Такие кристаллические сооружения уже не имеют свободных валентностей, а потому не могут присоединять к себе другие ионы и с формально-химической точки зрения являются окислами (кварц).
Для понимания строения силикатов чрезвычайно важно положение, выдвинутое В. И. Вернадским, установившим, что алюминий в силикатах может играть ту же роль, что и кремний.
В. И. Вернадский установил для таких соединений термин алюмосиликаты.
С точки зрения кристаллохимии замена иона кремния на ион алюминия может доходить до пятидесятипроцентного замещения, т. е. вместо группы [Si4О8]° может быть группа [Al2Si2О8]-2.
Изоморфизм
Замещение ионов кремния ионами алюминия возможно, так как их ионные радиусы сравнительно мало отличаются между собой; ионный радиус Si+4 — 0,39, а ионный радиус Аl+3 = 0,57.
Но потеря одной валентности при подобном замещении требует внедрения в кристаллическую решетку соответствующего количества ионов или одновалентных (Na или К) или двухвалентных (Са или Ва) элементов.
Тут же следует отметить, что ион алюминия может в силикатах заменить и ион Мg+2 (r =0,78А).
Такая замена также влечет за собой необходимость компенсации валентности во всей кристаллической решетке, но уже за счет уменьшения валентности второго заменяемого иона (например, Са» на Na’).
Какие бывают группы силикатов
На основании описанных структур вся группа силикатов может быть подразделена на 6 подгрупп.
1. Островные (ортосиликаты)
а) с мотивами (SiO4) — оливин, гранат;
б) с мотивами (Si2O7) — каламин;
в) смешанные, с мотивами (SiO4) и (Si2O7) — эпидот.
2. Кольцевые силикаты
а) с мотивами (Si3O9) — волластонит;
б) с мотивами (Si6O18)—берилл;
в) со сдвоенными кольцами (мотивами S12O30) — турмалин.
3. Цепные силикаты
а) с мотивами (Si2O6) ͚ и частично с Аl —пироксены;
б) с мотивами (SiAl)О6 ͚ — силлиманит.
4. Ленточные силикаты
а) с мотивами (Si4O11) ͚ и частично с Аl — амфиболы
5. Слоевые силикаты
а) с мотивами (Si4Ol0) ͚ — тальк, каолинит;
б) с мотивами [(Si4nAln)Ol0] — слюды.
6. Каркасовые силикаты
а) с мотивами (Si4O81) ͚ — кварц;
б) с мотивами [(Si-nAln)O8] ͚ — полевые шпаты и др.;
в) с содержанием цеолитной (легкоподвижной) — цеолиты.
г) Островные (орто) силикаты
Представители этой подгруппы характеризуются большой твердостью (8—6,5), сильным блеском и часто высокой температурой плавления и разложения.
Наиболее важной является семейство оливина, кристаллизующегося при еще очень высоких температурах одним из первых из магматического расплава.
Оливин (перидот)
Химический состав оливина: (Mg, Fe)2[SiО4]; тв. 6,5—7; уд. в. 3,3—3,4. Сингония ромбическая.
Цвет оливково-зеленый. Обычно встречается в зернах и зернистых массах, редко в кристаллах.
Диагностика, как определить. Для оливина характерны: желтовато-зеленый цвет, зернистая форма и довольно ясная спайность (отличие от зерен кварца в породах). Перед паяльной трубкой оливин не плавится.
Оливин важный породообразующий минерал, слагающий иногда почти целиком горные породы — дунит и перидотит.
Существенная составная часть некоторых габбро, базальтов и других основных и ультраосновных изверженных пород.
Встречается во всех горных областях, где распространены такие породы, как например, на Северном и Среднем Урале, где дуниты являются материнской породой платины.
При понижающейся температуре остывающей магмы оливин реагирует с расплавом и переходит в пироксен по схеме:
(Mg, Fe)2[SiO4] + SiO2 ⇄ (Mg, Fe)2[Si2O6]
При более низких температурах кристаллы оливина легко разлагаются горячими термальными растворами и переходят в серпентин согласно схеме:
3Mg2[SlO4] + SlO2 +.4Н2O = (OH)8Mg6 [Si4O10].
При этом небольшое количество железа, входящего в оливин, переходит в магнетит:
Fe2Fe32O4 = Fe3O4
Применение. Прозрачные разности (хризолит) применяются в ювелирном деле. Крупные массивы оливиновых пород (дунитов) имеют промышленное значение в виду высокого содержания в них магния.
Применяются в строительной, огнеупорной, химической промышленности.
Семейство гранатов
Вторым по важности семейством из подгруппы островных силикатов является семейство гранатов.
Общая формула гранатов:
R3»R2»’[SiO4]3, где R« — Са, Mg, Fe, Mn; R»’ — Al, Fe, Cr.
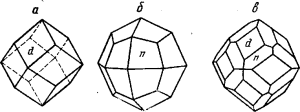
Гранаты кристаллизуются в кубической сингонии и встречаются главным образом в кристаллах, иногда очень хорошо образованных, преимущественно в виде ромбододекаэдров (а).
Иногда в комбинации с тетрагонтриоктаэдром (б). Гранаты — типичные минералы контактовых месторождений и кристаллических сланцев; иногда они образуются в пегматитовых жилах.
Нужно отметить такие разновидности:
1. Альмандин—Fe23Al2[SiО4]3,
2. Гроссуляр Ca3Al2[SiO4]3,
3. Андрадит Ca3Fe32 [SiO4]3,
4. Спессартин Mn3Al2[SiO4]3,
5. Пироп Mg3Al2[SiO4]3.
Самые распространенные из гранатов железо-кальциевые андрадиты Ca3Fe32[SiO4]3.
Альмандин
Химический состав альмандина — Fe23 Al2[SiO4]3. Тв. 7—7,5. Уд. в. 4,1—4,3.
Тёмнокрасного цвета, иногда прозрачен.
Альмандин встречается изредка в магматических горных породах. Типичный минерал слюдяных сланцев и, иногда, пегматитовых жил.
Гранаты встречаются на Урале, в особенности близ Златоуста на горе Таганай, где находят хорошо образованные кристаллы (рис. 6).
А также в Осиновском и Глубочинском месторождениях на Среднем Урале. Крупное месторождение абразивного граната находится в Карелии близ ст. Шуерецкой.
Диагностика как определить. Для альмандина и других гранатов очень характерны:
1. кристаллическая форма,
2. Изометрический облик кристаллов,
3. Жирный блеск,
4. Высокая твердость,
5. Сравнительно большой удельный вес.
Употребление. Прозрачные разновидности альмандина гранятся, как драгоценный камень.
Применение альмандина в ювелирном деле имеет также магнезиально-глиноземистый гранит (пироп) Mg3Al2[SiO4]3 кроваво-красного цвета и зеленый известково-железистый гранат — демантоид (андрадит), широко известный среди ювелиров под названием «хризолита».

Непрозрачные разновидности гранатов, главным образом альмандина, в меньшей степени андрадита и пиропа.
Применяются в абразивной промышленности в виде «гранатовой бумаги» (шкурки), идущей для шлифовки дерева, цветных металлов, кожи, кости, стекла и др.
Гранаты трудно разрушаются при выветривании и часто обнаруживаются в песке, накапливаясь иногда в россыпях.
Значительно менее распространенным, но практически важным является циркон.
Циркон
Химическим состав циркона Zr[SiO4]. Обычна незначительная примесь окиси железа, тория и гафния, тв; 7,5. Уд. в. 4,68—4,7. Сингония квадратная.
Цвет желто-бурый, медовый и буровато-красный; иногда бывает бесцветным или фиолетовым. Сильный алмазный блеск.
Диагностика , как определить. Для циркона характерны: призматический облик кристаллов, блеск, а часто и окраска.
Встречается обычно в мелких хорошо образованных кристаллах (рис. 7), в массивно-кристаллических породах и пегматитовых жилах.
Образуется при высоких температурах; генетически связан с кислыми и щелочными магмами. При разрушении коренных месторождений не изменяется п скопляется в россыпях.
Применение. В металлургии — как ценный огнеупорный материал. В ювелирной промышленности—как драгоценный камень (гиацинт).
Окись циркония применяется в стекольной и фарфоровой промышленности, а также при производстве эмалированной посуды.
Металлический Zr—в производстве качественной стали.

Топаз
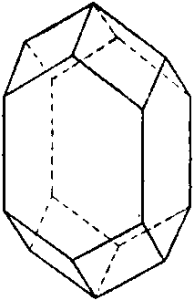
Химический состав топаза — Al2(F, OH)2[SiO4]. Тв. 8. Уд. в. 3,4—3,6. Сингония ромбическая.
Бесцветные, голубые, розовые и желтые кристаллы (рис. 8) обычно призматической формы, с совершенной спайностью (по 001).
Диагностика, как определить. Для топаза характерны форма кристаллов, высокая твердость и совершенная спайность.
В зернистых агрегатах топаз похож на кварц, от которого отличается большей твердостью, совершенной спайностью и более сильным блеском.
Топаз — типичный минерал пегматитовых и пневматолитовых жил. Встречается вместе с кварцем, полевым шпатом, слюдами, оловянным камнем, апатитом, бериллом и др.
В СНГ топазы известны на Урале-Мурзинка (к северу от Свердловска), Ильменские горы на Южном Урале—Кочкарская система (розовые топазы в россыпях).
В Сибири—Забайкалье— Шерлова гора и Борщовочный кряж. Крупные месторождения найдены на Украине, в районе дер. Писаревки на Волыни.
Применение. Топаз применяется как абразив, а также в качестве материала для опорных камней, подпятников и других частей точных приборов.
Прозрачные разновидности гранятся, как драгоценные камни. Несколько сходен с топазом по химическому составу.
Кианит (дистен)
Химический состав кианита: (АlOАl)[SiO4]. Тв. 5—7,25. Уд. в. 3,56—3,67. Сингония триклинная.
Твердость кианита по различным направлениям неодинакова, вдоль кристалла она равна 4, а поперек достигает 6, ввиду чего этот минерал называют также дистен (в переводе с греческого— двоякосопротивляюшийся). Спайность совершенная.
Цвет кианита синий, разных, оттенков, от голубого до зеленоватого и желтоватого, блеск стеклянный. Прозрачен или просвечивает.
Встречается в виде удлиненных плоских кристаллов, плохо образованных на концах.
Диагностика , как определить. Для кианита характерны плоские кристаллы обычно синего цвета и неодинаковая твердость, в зависимости от направления (рис. 9).
Кианит — характерный минерал кристаллических сланцев глубинных зон метаморфизма и некоторых пегматитовых жил.
В СНГ известен ряд крупных месторождений кианита. Как химически прочный минерал часто встречается в песках и песчаниках.
Применение. Кианит — ценный материал для огне упорных и кислотоупорных изделий. Прозрачные разности гранятся для ювелирных изделии.

Широко распространены в земной коре вторичные силикаты семейства эпидота.
Эпидот
Химический состав эпидота— Са2(Аl, Fe)3O ∙ OH(SiO4) (Si2O7) Тв. 6,5. Уд. в. 3,3—3,5. Сингония моноклинная.
Цвет фисташково-зеленый, иногда бурый и розовый (тулит). Встречается в плотных массах, шестоватого сложения. Кристаллизуется в призматических кристаллах, нередко прекрасно образованных.
Обладает совершенной спайностью в одном направлении.
Диагностика , как определить. Для эпидота характерны желтовато-зеленая (фисташковая) окраска, спайность и стеклянный блеск. На призматических кристаллах эпидота часто заметна продольная штриховка.
Эпидот встречается в трещинах и жилах, а также образуется в областях контакта. Он часто образуется из силикатов, в особенности из основных полевых шпатов и роговой обманки (позеленение пород) при их вторичных изменениях.
Прекрасными кристаллами эпидота славится Ахматовская копь (Южный Урал, Златоустовский район).
Представителем силикатов со сдвоенными кремнекислородными тетраэдрами может служить каламин.
Каламин (гемиморфит, кремнекислый цинк)
Химический состав каламина — Zn4(OH)2[Si2O7]H20. Тв. 4,5—5. Уд. в. 3,4—3,5. Сингония ромбическая.
Обычно в мелких кристаллах; образует сплошные зернистые массы и натечные почковидные формы белого, голубого, зеленоватого, бурого и серого цветов.
Диагностика, как определить. Каламин в плотных агрегатах и натечных формах похож на смитсонит, от которого отличается по реакции с кислотами.
При действии кислоты смитсонит вскипает, а каламин этой реакции не дает. Образуется в верхних частях рудных жил вместе с смитсонитом (ZnCO3) при выветривании цинковой обманки (ZnS).
Такая смешанная руда носит название галмей и является весьма распространенной.
Употребление. Хорошая руда на цинк.
Статья на тему Что такое силикаты


Добавить комментарий
Для отправки комментария вам необходимо авторизоваться.