Физические свойства воды
Чистая вода представляет собой бесцветную прозрачную жидкость, не имеющую ни запаха, ни вкуса. Вес 1 мл чистой воды при 4° принимается за единицу веса и называется граммом.
В отличие от большинства других веществ, плотность которых при охлаждении непрерывно увеличивается, вода обладает при 4° наибольшей плотностью. Как выше, так и ниже этой температуры плотность воды меньше. Указанная аномалия воды имеет очень большое значение. Благодаря ей глубокие водоемы не промерзают зимой до дна и в них сохраняется жизнь.
Не меньшее значение в жизни природы имеет и другая аномалия воды — из всех твердых и жидких веществ вода имеет наибольшую теплоемкость. Поэтому в зимнее время она медленно остывает, а летом медленно нагревается, являясь, таким образом,, регулятором температуры на земном шаре.
Температура замерзания чистой воды принимается за начальную точку стоградусной термометрической шкалы и обозначается цифрой 0, температура кипения воды при нормальном давлении отмечается на шкале цифрой 100.
Весовой состав воды выражается следующими числами: 11,11% водорода и 88,89% кислорода. Отсюда простейшая формула воды будет Н2О. Определение молекулярного веса воды по плотности ее пара при высоких температурах дает величину, равную 18, что отвечает простейшей формуле. Однако с приближением к точке кипения воды плотность пара слегка увеличивается и молекулярный вес получается несколько больше 18. Молекулярный вес жидкой воды, определяемый, путем растворения ее в подходящих растворителях , тоже оказывается более высоким, чем можно было бы ожидать на основании простейшей формулы. Все эти факты привели к заключению, что жидкая вода наряду с простыми молекулами Н2О и в равновесии с ними содержит более сложные молекулы, состав которых выражается общей формулой (Н2О)х. Такое соединение простых молекул в более сложные, не вызывающее изменения химической природы вещества, носит название ассоциации молекул.
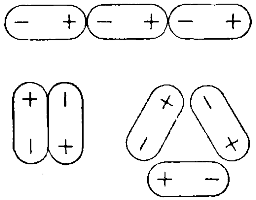
Ассоциация молекул обусловливается, вообще говоря, их полярностью, благодаря которой молекулы притягиваются друг к другу своими разноименными полюсами, образуя удвоенные, утроенные и так далее молекулы (рис. 60). Но для воды основной причиной ассоциации является образование так называемых «водородных» связей между молекулами.
Исследованиями установлено, что атом водорода, ковалентно связанный с атомом сильно электроотрицательного элемента (особенно фтора или кислорода), может вступать в связь еще с другим атомом такого же элемента. Эта вторая связь и называется водородной связью.
Такая особенность водородного атома обусловливается тем, что, отдавая свой единственный электрон на образование связи с сильно электроотрицательным элементом, он остается в виде ядра очень малого размера, почти лишенного электронной оболочки. Поэтому он не испытывает отталкивания от электронной оболочки другого атома, а наоборот, притягивается ею и может вступать с ней во взаимодействие.
В жидкой воде водородная связь образуется между атомом водорода одной молекулы воды и атомом кислорода другой молекулы воды согласно схеме
в которой водородные связи отмечены точками. Таким же путем образуются в воде и более сложные молекулярные агрегаты.
Наибольшей устойчивостью обладают удвоенные молекулы (Н20)г, образование которых, повидимому, сопровождается возникновением двух водородных связей:
Ассоциацией молекул воды могут быть объяснены и те аномалии в ее свойствах, о которых мы говорили выше. Предполагают, что при 0° вода в значительной мере состоит из молекул (Н2О)3. При нагревании от 0° до 4° утроенные молекулы диссоциируют с образованием молекул (Н2О)2, которые сообщают
воде большую плотность, вероятно вследствие наличия в них двух водородных связей. Дальнейшее нагревание ведет к распаду двойных молекул на простые, и плотность воды постепенно уменьшается. Но даже при 100° вода и водяной пар еще содержат некоторое количество двойных молекул, вследствие чего плотность водяного пара при 100° не вполне отвечает простейшей формуле воды Н2О.
Большая теплоемкость воды также может быть объяснена диссоциацией сложных молекул при нагревании. Так как процесс диссоциации сопровождается поглощением тепла, то при нагревании воды тепло расходуется не только на повышение температуры, но и на разложение ассоциированных молекул. В о д я н о й п а р. Как и всякая жидкость, находящаяся в открытом сосуде, вода более или менее быстро испаряется. Если же поместить жидкость в замкнутое пространство, пустое или уже занятое каким-либо газом, то она будет испаряться лишь до тех пор, пока между нею и образующимся из нее паром не установится динамическое равновесие, при котором в единицу времени столько же молекул испаряется, сколько и переходит обратно в жидкость. Пар, находящийся в равновесии с жидкостью, из которой он образовался, называется насыщенным. Давление его при данной температуре у различных жидкостей различно. Например, при 20° давление насыщенного пара воды равно 17,4 мм, спирта — 43,9 мм, эфира — 442 мм и т. д. Испарение — эндотермический процесс. Поэтому повышение температуры в соответствии с принципом Ле-Шателье смещает равновесие между жидкостью и ее паром в сторону парообразования и давление пара увеличивается.
Давление водяного пара при различных температурах выражается следующими цифрами:
Температура в °С . . . 0 20 40 60 80 100
Давление в мм рт. ст. 4,6 17,4 55,0 149,2 355,5 760
Когда давление пара какой-либо жидкости достигает величины внешнего давления, жидкость закипает. Температура кипения воды при нормальном атмосферном давлении равна 100°, потому что при этой температуре давление водяного пара равно 760 мм.Превращение воды в пар сопровождается поглощением большого количества тепла. Так, чтобы превратить 1 моль воды, имеющей температуру 100°, в пар при той же температуре, надо затратить 9,7 ккал. При обратном превращении, пара в воду это же количество тепла выделяется.
Лед. Если отнимать тепло от воды, имеющей температуру 0° и находящейся под обыкновенным давлением, то вода переходит в твердое состояние — лед. Наоборот, если нагревать лед, имеющий температуру 0°, то он тает, превращаясь в воду. Смесь воды и льда остается при 0° без изменения, если она не получает тепла и не отдает его во внешнее пространство.
На этом основании температуру замерзания или, что то же, температуру плавления можно определить как такую температуру, при которой жидкость находится в равновесии с твердой фазой того же вещества.
Выделение тепла при замерзании воды (равно как и поглощение тепла при таянии льда) составляет 1,42 ккал на каждый моль воды.
Переход воды в лед сопровождается значительным увеличением объема, вследствие чего удельный вес льда равен только 0,92, т. е. лед легче воды. С увеличением давления точка перехода воды в лед сперва понижается (например, под давлением 615 ат вода замерзает только при —5°), но затем (после 2000 ат) начинает повышаться и при очень больших давлениях становится выше 0°.
Исследования показали, что под давлением выше 2000 ат, кроме обыкновенного льда, могут существовать еще пять различных форм льда с удельным весом выше единицы, которые обозначаются римскими цифрами II, III, IV, V и VI. Для льда VI, образующегося под давлением 20 760 ат, предложено название «горячий лед», так как он плавится при +76°.
Лед, как и вода, может испаряться. В замкнутом пространстве испарение льда продолжается до тех пор, пока давление образующегося из него пара не достигнет некоторой определенной для данной температуры величины. Давление пара льда при 0° такое же, как и давление водяного пара при 0°, т. е. равно 4,6 мм. С понижением температуры давление пара льда быстро уменьшается: при минус 20° оно равняется только 0,8 мм, а при минус 50° составляет всего 0,3 мм. Поэтому испарение льда идет гораздо медленнее, чем испарение воды.
Показанная выше зависимость между давлениием водяного пара и температурой, а также условия одновременного существования воды в различных фазах могут быть наглядно представлены при помощи так называемой диаграммы состояния воды (рис. 61).
На этой диаграмме линия OA представляет кривую давления паров воды, а линия ОВ — кривую давления паров льда. Точки кривой OA показывают, при каких температурах и давлениях могут одновременно существовать в равновесии вода и пар; точки кривой ОВ определяют условия равновесия между льдом и паром. Обе кривые пересекаются в точке О,указывающей температуру и давление, при которых могут находиться в равновесии все три фазы. Поэтому точка О называется тройной точкой; ей отвечает давление 4,6 мм и температура +0,007°. Кривая ОС показывает влияние давления на точку плавления льда. Каждой ее точке соответствует определенное давление и определенная температура, при которых лед и вода находятся в равновесии. Кривые OA, ОВ и ОС делят всю площадь диаграммы на три области, из которых каждая соответствует устойчивости только одного из трех агрегатных состояний воды. При температурах и давлениях, отвечающих точкам, лежащим в области АОС,. вода может существовать только в жидком состоянии. Точно так. же точки областей, отмеченных на диаграмме словами «лед» и «пар», определяют те температуры и давления, при которых возможно существование только твердой или только газообразной фазы.
Вы читаете, статья на тему Физические свойства воды

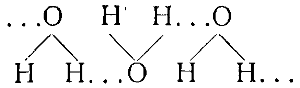

Добавить комментарий
Для отправки комментария вам необходимо авторизоваться.