В промышленности серная кислота получается окислением сернистого ангидрида до серного, с последующим взаимодействием образовавшегося продукта с водой.
Необходимый для производства кислоты сернистый ангидрид получают в технике рядом способов.
Наиболее распространенным из них является обжиг железного колчедана FeS2 в особых печах при доступе воздуха:
4FeS2 + 11O2= 2Fe2O3 + 8SO2
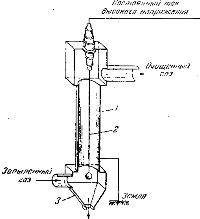
Рис. Схема электрофильтра: 1 — труба; 2 — провод; 3 — бункер
Техническое получение серной кислоты
В СНГ, вместо специально добываемой для этой цели руды — пирита, обжигу подвергают преимущественно так называемый флотационный колчедан — продукт.
Получаемый при флотации медных руд с низким содержанием меди, и углистый колчедан, получаемый при обогащении каменных углей с высоким содержанием серы.
Образующаяся при обжиге колчедана окись железа («колчеданный огарок») удаляется из печей и может быть использована для получения железа.
А смесь сернистого ангидрида с кислородом и азотом воздуха пропускается через ряд аппаратов, в которых она освобождается от пыли и других примесей.
Для освобождения газов от пыли и взвешенных частиц в настоящее время широко пользуются электростатическим методом очистки.
Подлежащие очистке газы пропускаются через электрофильтр (рис.), в простейшем случае состоящий из широкой железной трубы, вдоль оси которой проходит тонкий железный провод, соединенный с отрицательным полюсом источника тока высокого напряжения.
Труба и положительный провод заземлены. При огромной разности потенциалов, доходящей до 200 тыс. вольт, напряжение поля в непосредственной близости от провода достигает такой величины, что происходит ионизация воздуха.
Образующиеся отрицательно заряженные ионы движутся к внутренней поверхности трубы, а положительно заряженные — к проводу.
Встречаясь с пылинками, ионы заряжают их.
Так как вне области ионизации, составляющей ничтожную часть всего пространства трубы, движутся только отрицательные ионы.
То основная масса пыли, проходящей через электрофильтр, заряжается отрицательно и, притягиваясь к внутренней поверхности трубы, оседает на ней.
Пылинки, заряжающиеся положительно, оседают на отрицательном проводе. Осаждение происходит практически полностью.
Сернистый ангидрид получают также сжиганием серы.
В этом случае образуется газ, свободный от вредных примесей; поэтому отпадает необходимость в очистительной системе, что значительно упрощает производство серной кислоты.
Весьма важным источником получения сернистого ангидрида являются отходящие газы заводов цветной металлургии.
Значение этого источника видно хотя бы из того, что при выплавке 1 т меди образуется 7,5 г SO2, из которого можно получить более 10 г серной кислоты.
Большое количество сернистого ангидрида содержится в топочных газах, особенно при сжигании каменного угля со значительным содержанием серы.
Сырьем для получения сернистого ангидрида является также сернокислый кальций, встречающийся в природе в виде гипса CaSО4 • 2Н2О и ангидрита CaSО4.
Эти минералы при температуре 1850—1400° разлагаются по реакции:
2CaSО4 = 2СаО + 2SО2 + О2
При добавлении к сернокислому кальцию угля температура разложения может быть значительно понижена.
Если прокаливать гипс, смешанный в необходимой пропорции с окисью железа Fe2О3, окисью алюминия Аl2O3 и кремнеземом SiO2, то одновременно с сернистым ангидридом получается цемент.
Окисление сернистого ангидрида при получении серной кислоты производится двумя методами: контактным и нитрозным.
Контактный метод основан на присоединении кислорода к сернистому ангидриду при соприкосновении (контакте) этих газов с катализатором.
При получении серной кислоты контактным методом смесь сернистого газа и воздуха после освобождения от примесей проходит через особый подогреватель, обогреваемый выходящими из контактного аппарата газами, и поступает в контактный аппарат.
Схема одного из таких аппаратов показана на рис. 2. Он представляет собой большой цилиндр, внутри которого находятся четыре решетчатые полки.
На полках помещают катализатор. Газ входит в аппарат сверху, проходит через четыре слоя контактной массы и уходит из аппарата снизу.
На катализаторе происходит окисление сернистого ангидрида в серный ангидрид, сопровождающееся выделением значительного количества тепла:
2SO2 + O2 ⇄ 2SO3 + 46 ккал
Температура в контактном аппарате поддерживается около 450°, так как ниже 450° соединение газов происходит слишком медленно, а выше 450°усиливается обратная реакция.
Например, при 700° и обычном составе газовой смеси, получаемой путем обжига колчедана (7% SO2, 11% O2 и 82% N2), только15% SO2 превращается в SO3.
Увеличение содержания кислорода в смеси повышает выход серного ангидрида, смещая равновесие реакции вправо.
На практике при 450° и имеющемся в газовой смеси избытке кислорода степень превращения SO2 в SO3 достигает 95-97%,
Обязательным условием успешного протекания процесса является полное удаление примесей, так как даже ничтожные следы некоторых веществ.
Соединений мышьяка, фосфора и др. «отравляют» катализатор, вызывая быструю потерю им своей активности.
Образовавшийся серный ангидрид выходит из контактного аппарата в состоянии очень мелкого распыления.
В таком виде он не поглощается водой.
Для поглощения его пропускают в 96—98%-ную серную кислоту, которая, насыщаясь серным ангидридом, превращается в олеум.
Разбавляя последний водой, можно получить очень чистую серную кислоту любой концентрации.
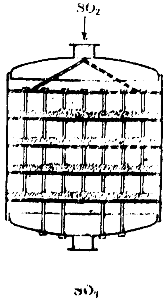
Рис. 2. Схема контактного аппарата.
В качестве катализатора для окисления сернистого ангидрида ранее служил платинированный асбест.
В последнее время вместо, него применяют ванадиевый ангидрид V2O5 и некоторые другие соединения ванадия.
Ванадиевые катализаторы по активности мало уступают платине, но дешевле ее и не так легко отравляются, что позволяет значительно упростить очистку газов.
В России производство серной кислоты по контактному методу впервые было поставлено на Тентелевском заводе (ныне завод «Красный химик») в Петербурге.
Разработанная химиками этого завода «тентелевская система» была одной из самых совершенных систем своего времени и получила мировую известность.
По этой системе были построены контактные установки в ряде стран, в том числе в Японии и США.
Нитрозный метод
Контактный метод получения серной кислоты стал применяться сравнительно недавно.
До этого серную кислоту получали исключительно нитрозным методом, сущность которого заключается в окислении сернистого газа двуокисью азота NO2 в присутствии воды.
Двуокись азота получается из азотной кислоты; она представляет собой красно-бурый газ, который реагирует с сернистым газом по уравнению:
SO2 + NO2 + Н2O = H2SO4 + NO
Отдавая сернистому газу часть кислорода, двуокись азота превращается в бесцветный газ — окись азота NO.

Рис. 3. Схема башенной установки для получения серной кислоты: I и II — продукционные башни; III — окислительная башня; IV и V — поглотительные башни; 1 — колодильники; 2 —сборник готовой продукции; 3— вентилятор.
Последний обладает замечательной способностью присоединять к себе кислород прямо из воздуха и снова превращаться в двуокись азота:
2NO + O2 = 2NO2
которая идет на окисление новых порций сернистого газа.
Таким образом, окись азота при производстве серной кислоты теоретически не расходуется и является по существу катализатором, ускоряющим процесс окисления сернистого газа .
Нитрозный метод получения серной кислоты осуществляется на практике двумя способами, которые носят названия камерного и башенного процессов.
Так как камерный процесс устарел и почти нигде не применяется, то мы опишем только башенный процесс.
На рис. 3 изображена схема башенной установки.
Выходящие из колчеданных печей очищенные от пыли горячие газы, содержащие сернистый ангидрид, проходят вначале через «продукционные» башни I и II.
Наполненные кислотоупорными керамитовыми кольцами и орошаемые так называемой нитрозой.
Последняя представляет собой серную кислоту, в которой растворена и нитрозилсерная кислота NOHSO4, являющаяся по своей структуре смешанным ангидридом серной и азотистой (HNO2) кислот.
Как это видно из следующей схемы:
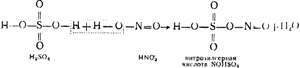
Кроме нитрозы, в башни I и II вводится также вода.
Благодаря высокой температуре газов нитрозилсерная кислота подвергается гидролизу, в результате которого получаются серная и азотистистой кислоты:
NOHSO4 + Н2O = H2SO4 + HNO2
Азотистая кислота окисляет сернистую кислоту, образую-щуюся из сернистого газа и воды, в серную кислоту:
H2SO3 + 2HNO2 = H2SO4 + 2NO + Н2O
Режим продукционных башен регулируют так, чтобы перевести в серную кислоту до 90% всего исходного количества SO2.
Затем газы, содержащие NO2 и NO, проходят через башню III и две «абсорбционные» башни IV и V, наполненные насадкой из керамиковых колец и орошаемые серной кислотой.
В адсорбционных башнях происходит образование нитрозилсерной кислоты:
NO2 + NO + 2H2SO4 = 2NOHSO4 + H2O
Таким образом, окислы азота улавливаются в этих башнях и не попадают в атмосферу.
Газ, выходящий из башни II, содержит окислы азота преимущественно в виде NO.
Чтобы обеспечить необходимое для протекания процесса соотношение между NO и NO2 в газовой смеси, служит башня III.
В этой башне, не заполненной насадкой и не орошаемой, происходит окисление необходимого количества окиси азота в двуокись.
Образующаяся в башне I серная кислота выводится из системы и, после охлаждения в холодильнике 1,направляется в сборник готовой продукции 2; некоторая часть ее поступает на орошение башни V. Серная кислота из башни II идет на орошение башни IV.
Перемещение жидкости из башни в башню осуществляется насосами.
Движение газов в системе поддерживается с помощью мощного вентилятора, устанавливаемого между четвертой и пятой башнями.
Происходящая при башенном процессе некоторая потеря окислов азота возмещается введением в продукционные башни I и II 50—60%-ной азотной кислоты.
Применение кислоты
Серная кислота является одним из важнейших продуктов так называемой основной химической промышленности, к которой относится производство кислот, щелочей, солей, минеральных удобрений и хлора.
Ни один химический продукт не производится в таком огромном количестве, как серная кислота.
Основным потребителем серной кислоты является производство минеральных удобрений (например, суперфосфата и сульфата аммония).
Затем она служит для приготовления почти всех других кислот из их солей, применяется в большом количестве при производстве взрывчатых веществ, для очистки керосина, нефтяных масел и продуктов коксохимической промышленности (бензола, толуола).
Для получения различных купоросов, при изготовлении красок, травлении черных металлов (снятие окалины) и т. д.
Производство серной кислоты в 1956 г. только в капиталистических странах составляло 33,8 млн. г.
Производство серной кислоты до революции и после военный период
До Октябрьской революции производство серной кислоты в России было ничтожным по сравнению с производством ее в других странах.
Небольшие сернокислотные заводы работали почти исключительно на импортном колчедане.
Продукция всех заводов составляла в 1913 г. всего около 145 тыс. т.
После революции положение резко изменилось. Старые заводы были расширены и заново переоборудованы.
Была создана отечественная сырьевая база для сернокислотной промышленности и построен ряд новых заводов, что обеспечило рост производства серной кислоты.
В 1940 г. ее выработка увеличилась до 1587 тыс. г, в 1955 г. достигла 3798 тыс. т, а в 1959 г. 5100 тыс. т.
Развитие сернокислотной промышленности шло по линии строительства башенных и контактных установок.
Прежние камерные установки были полностью заменены башенными.
В печных отделениях большинства сернокислотных заводов установлены мощные механические печи и специальные печи для обжига флотационного колчедана во взвешенном состоянии.
Контрольными цифрами развития народного хозяйства СССР на 1959—1965 гг. намечается значительно увеличить производство серной кислоты (более чем в 2 раза по сравнению с 1958 г.).
Сернокислотная промышленность будет все в больших масштабах использовать в качестве сырья элементарную серу, отбросные газы черной и цветной металлургии, а также сероводород.
Широкие перспективы открывает перед сернокислотной промышленностью применение кислорода и обжиг колчедана в «кипящем слое».

Добавить комментарий
Для отправки комментария вам необходимо авторизоваться.