Структура молекул «АРХИТЕКТУРА» МОЛЕКУЛ
Свойства молекулы в основном определяются типом связи между атомами в молекуле и молекулярной «архитектурой» или структура молекул.
Под архитектурой мы подразумеваем структуру молекулы — ее форму.
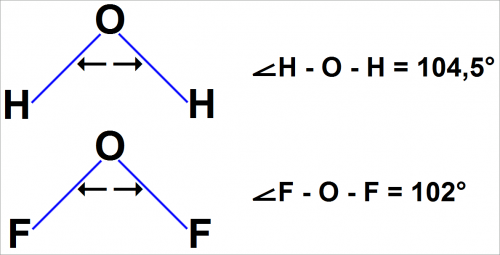
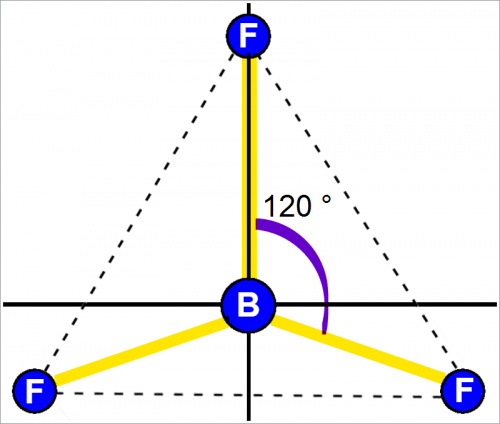
Форма молекулы воды Н2О и фторид кислорода (II) F2O
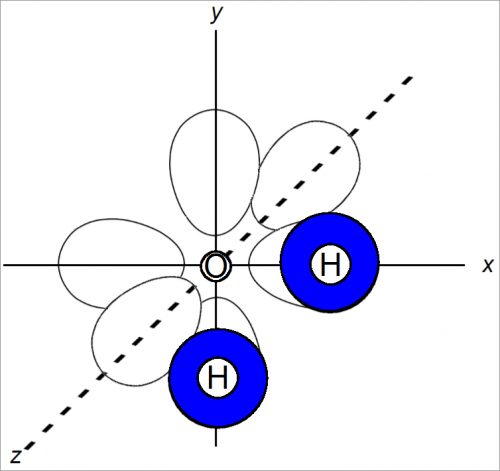
Изображение связей в молекулах Н2О и F2O с помощью электронных орбит предполагает, что в образовании связей участвуют две р-орбиты кислорода.
На рис. ниже показано пространственное расположение, принятое для р-орбит (в предположении, что они подобны орбитам атома водорода).
Если пространственное расположение орбит после образования связей остается прежним, то форма молекулы будет такой, как показано на рис. 1.
Атомы в молекуле расположены под углом около 90°. То же справедливо и для молекулы F2O.
Измерение углов дает следующие величины:
Как правило, можно считать, что двухвалентный атом с двумя валентными р-орбитами образует изогнутую молекулу.
Поскольку это предсказание вполне надежно, химические связи обычно характеризуют путем определения валентных орбит.
Для кислорода говорят, что он использует р2-связь (читается «р два») в Н2О и F2O.
Следует отметить, что в структурных формулах (рис. 1-1) и (рис. 1-2) связи изображены иначе.
Так как соответствует модели атома в виде шарика с иголками в направлении связей.
Черточки между атомом кислорода и обоими атомами водорода указывают, что между каждой парой атомов существует связь.
Между двумя атомами водорода черточки нет, так как известно, что между ними нет непосредственной связи.
Теперь становится ясной зависимость между распределением электронов и черточками, изображающими связь.
Черточка между двумя атомами показывает, что пара электронов обобщена этими двумя атомами, в результате чего возникла химическая связь.
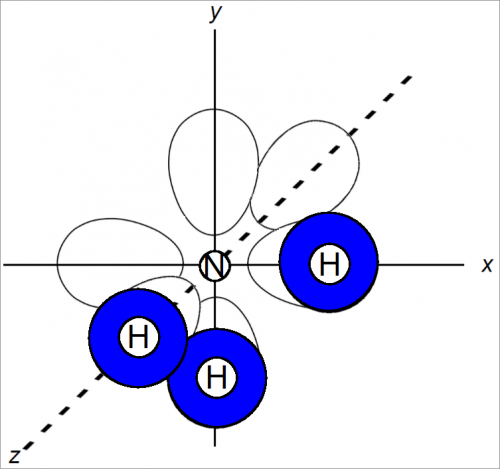
Форма молекулы аммиака NH3 и фторида азота (III) NF3
В молекулах NH3 и NF3 в образовании связей участвуют три р-орбиты. На рис. 2 показано пространственное расположение р-орбит в предположении, что после образования связей орбиты атома водорода сохраняют прежнее расположение.
Мы полагаем, что аммиак имеет форму правильной пирамиды с атомом азота в вершине. Углы между связями должны быть около 90°.
Обе молекулы — NH3 и NF3— имеют форму правильной пирамиды.
Измерение углов между связями дает следующие величины:
Согласно экспериментальным данным, как правило, можно считать, что трехвалентный атом с тремя валентными р-орбитами образует молекулу, имеющую форму пирамиды.
Такая связь называется р3-связью (читается «р три»)
Форма молекулы метанаCН4 и четырехфтористого углерода CF4
В образовании связей в молекулах метана СН4 и четырехфтористого углерода CF4 участвуют четыре валентные орбиты — одна 2s-орбита и три 2р-орбиты.
Углерод образует четыре связи; как и раньше, эта связь характеризуется наименованием валентных орбит:
sp3 (читается «sр три»).
Однако на этот раз предположение о сохранении пространственного расположения орбит атома водорода не указывает непосредственно на то, что в таких молекулах можно ожидать образования углов между связями.
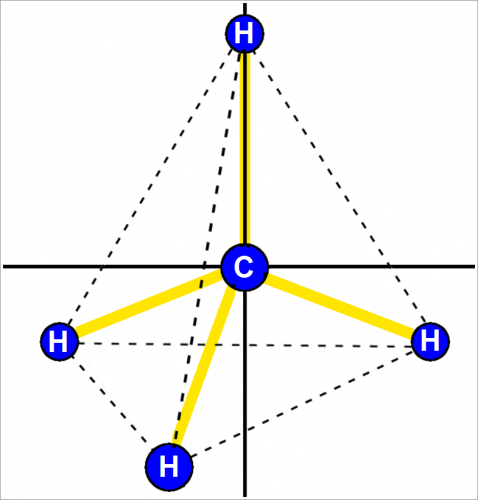
Тем не менее опыты показали, что между sр3-связями всегда образуются углы, которые точно или очень близко соответствуют углам тетраэдра.
Это значит, что угол между любыми двумя углерод-водородными связями равен 109°28′.
Такая структура называется тетраэдрической, так как четыре атома водорода расположены в вершинах правильного тетраэдра (четырехгранная фигура с равными гранями).
Тетраэдрическая структура показана на рис. выше.
Форма молекулы трифторида бора BF3
Атом бора в молекуле BF3 использует для образования связей одну 2s — орбиту и две 2р-орбиты.
Такая связь называется sр2-связью. Углы между связями, характерные для sр2-связи, также можно измерить.
Структура BF3 представляет собой равносторонний треугольник.
Такая структура плоская, и каждый из трех атомов фтора находится на таком же расстоянии от атома бора, как и два других атома фтора (рис. выше).
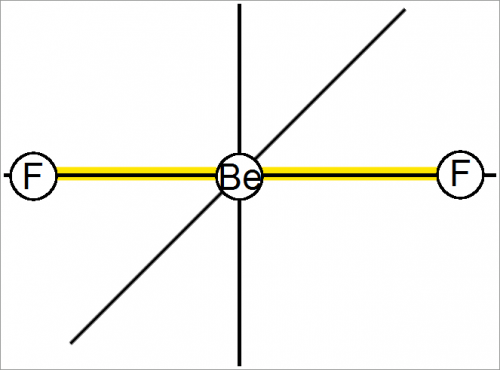
Форма молекулы фторида бериллия BeF2
Атом бериллия в газообразном BeF2 использует одну 2s— и одну 2р-орбиту. Такая связь называется sp-связью.
Согласно экспериментальным данным, молекула линейна и симметрична, как показано на рис. выше.
Структура газообразного ВеН2 по аналогии с BeF2 тоже, несомненно, линейна и симметрична.
Выводы
Из приведенных здесь данных следует, что электронные орбиты, использованные при образовании связей, определяют молекулярную «архитектуру»
Эта зависимость характеризуется данными таблами ниже.
Форма молекулы и электрические диполи
Рассмотрим фториды элементов второго периода. У фторидов таких элементов, как F, О, N, С, В, Be и Li, наблюдается непрерывное изменение ионного характера связей.
Ионный характер связей усиливается с увеличением разности между энергиями ионизации. Этот ионный характер связей обеспечивает существование электрического диполя в каждой связи.
Молекулярный диполь определяется геометрической суммой дипольных моментов всех связей.
Поскольку свойства молекулы в значительной степени зависят от молекулярного диполя, посмотрим, как можно судить о его величине, зная молекулярную архитектуру и ионный характер отдельных связей.
Таблица связывающие орбиты, способность к образованию связей и форма молекул
| Элемент | Связывающие орбиты | Способность к образованию связей | Форма молекулы фторида | Пример |
| Не | Нет | 0 | Одноатомная | Не |
| Li | s | 1 | Линейная двухатомная молекула | LiF |
| Be | sp | 2 | Линейная | BeF2 |
| В | sp2 | 3 | Плоская треугольная | BF3 |
| С | sp3 | 4 | Тетраэдр | CF4 |
| N | р3 | 3 | Пирамида | NF3 |
| О | р3 | 2 | Изогнутая | OF2 |
| F | р | 1 | Линейная двухатомная молекула | F2 |
| Ne | Нет | 0 | Одноатомная | Ne |
Молекулярный диполь LiF. Связь во фтористом литии имеет сильный характер вследствие большой разности между энергиями ионизации лития и фтора.
Следовательно, газообразный фтористый литий чрезвычайно высоким электрическим диполем.
Молекулярный диполь BeF2
Связь бериллий — фтор тоже имеет сильный ионный характер. Однако молекула BeF2 имеет две связи Be—F.
Поэтому электрические свойства всей молекулы зависят от того, как эти две связи ориентированы по отношению друг к другу.
Можно найти «геометрическую сумму» этих двух диполей связей.
Теперь мы можем применить, этот метод сложения к молекуле BeF2.
В линейной симметричной молекуле BeF2 два диполя связей направлены в противоположные стороны.
Поскольку обе связи равноценны, наблюдается полная компенсация.
Следовательно, молекула не имеет результирующего диполя; молекулярный диполь равен нулю.
Молекулярные диполи BF3 и CF4
Предполагается, что связи в этих молекулах имеют слабо ионный характер. Однако их молекулярные диполи точно равны нулю.
Тщательное изучение геометрии этих молекул показывает, что диполи связей в молекулах полностью компенсируют друг друга.
Молекулярный диполь равен нулю.
Молекулярный диполь в F2O
Поскольку молекула F2O, имеющая p2-связь, изогнута, два диполя связей взаимно не компенсируются, как это наблюдается в BeF2.
С другой стороны, энергии ионизации кислорода и фтора различаются не очень сильно, поэтому электрический диполь каждой связи мал по величине.
Диполи складываются в соответствии с геометрическими правилами, образуя полярную молекулу.