Степень диссоциации

Аномально высокое осмотическое давление в растворах электролитов объясняется диссоциацией их молекул на ионы. Если бы все растворенные молекулы распадались на ионы, то следовало бы ожидать, что осмотическое давление в растворах электролитов всегда будет в целое число раз больше нормального, наблюдаемого в эквимолекулярных растворах неэлектролитов. Между тем еще Вант-Гофф, определяя коэффициент i для растворов различных солей, нашел, что этот коэффициент выражается дробными числами, приближающимися, однако, к целым числам 2, 3, 4… с увеличением разбавления раствора.
Для объяснения этих фактов Аррениус выдвинул предположение, что в обычных растворах только часть молекул диссоциирована на ионы, и тем меньшая, чем концентрированнее раствор.
Причина неполной диссоциации, по мнению Аррениуса, заключается в том, что в растворе наряду с распадом молекул на ионы происходит и обратный процесс — соединение ионов в молекулы. В то время как скорость диссоциации по мере распада молекул уменьшается, скорость обратного процесса увеличивается. В результате устанавливается состояние равновесия, при котором относительные количества недисеоциированных молекул и ионов остаются постоянными, т. е. диссоциация не доходит до конца.
Таким образом, электролитическая диссоциация, как и всякая диссоциация, представляет собой обратимый процесс, что и выражается в уравнениях диссоциации двумя стрелками, заменяющими знак равенства, например:
NaCl⇄ Na• + Сl’ КОН ⇄ K•+ ОН’
Диссоциация кислот, например диссоциация НСl, должна быть выражена следующим образом:
НСl + Н2O ⇄ Н3O• + Cl’
Если при этом прямая реакция заключается в отщеплении протона от молекулы хлористого водорода и его присоединении к молекуле воды, то обратная — в отщеплении протона от иона гидроксония Н3O• и его присоединении к иону Cl’ с образованием молекулы НСl. Ион хлора по отношению к иону гидроксония играет ту же роль, что и молекула воды по отношению к молекуле хлористого водорода.
В упрощенной форме уравнение диссоциации хлористого водорода записывают так:
НСl ⇄ Н•+ Сl’
Однако при такой записи (к которой и мы будем часто прибегать) всегда следует иметь в виду, что при диссоциации кислот происходит не просто распад молекул на ионы, а более ‘сложная химическая реакция с участием молекул воды.
Отношение числа диссоциированных молекул к общему числу растворенных молекул называется степенью диссоциации электролита. Например, если из каждых 100 молекул НСl, которые были растворены в воде, 78 диссоциировало на ионы, то степень диссоциации равна 0,78, или 78%. Следовательно, степень диссоциации показывает, какая часть растворенных молекул распалась на ионы.
Степень диссоциации зависит как от природы растворенного электролита, так и от концентрации раствора: при разбавлении раствора степень диссоциации й каждого электролита увеличивается. Это значит, что существующее в растворе равновесие между недиссоциированными молекулами и ионами смещается в сторону образования ионов. Нетрудно убедиться, что такое смещение равновесия находится в полном согласии с принципом Ле-Шателье. Действительно, разбавляя раствор водой, мы уменьшаем концентрацию находящихся в растворе частиц—молекули ионов, а следовательно, уменьшаем и осмотическое давление раствора. Уменьшение же давления должно вызвать сдвиг равновесия в сторону той реакции, которая снова увеличит давление, т. е. в сторону образования большего числа ионов.
Так как степень диссоциации зависит от концентрации раствора, то, говоря о величине степени диссоциации электролита, необходимо указывать и концентрацию соответствующего раствора.
Числовые значения степени диссоциации электролитов могут быть определены различными методами. Познакомимся с методом, основанным на определении изотонического коэффициента для данного раствора.
Изотонический коэффициент i , как уже указывалось выше , показывает, во сколько раз осмотическое давление, повышение точки кипения и понижение точки замерзания, фактически наблюдаемые в растворе электролита, больше тех же величин, вычисленных теоретически в предположении, что растворенное вещество не диссоциирует:
Так как все эти величины пропорциональны числу находящихся в растворе частиц растворенного вещества, то очевидно, что изотонический коэффициент должен равняться отношению общего числа находящихся в растворе молекул и ионов к числу взятых для растворения молекул. Исходя из этого, нетрудно выразить зависимость между изотоническим коэффициентом и степенью диссоциации в математической форме.
Положим, что в воде растворено N молекул электролита, диссоциирующих каждая на п ионов.
Если обозначить степень диссоциации через α, то число распавшихся на ионы молекул будет равно Nα, число образовавшихся ионов — N αn и число оставшихся цедиссоциированными молекул — N (1 —а). Следовательно, общее число находящихся в растворе частиц (молекул и ионов) будет равно:
N (1 — α) + Nαn или N [(n — 1) α + 1]
а так как число растворенных молекул мы обозначили через N, то для изотонического коэффициента получаем следующее выражение:
откуда степень диссоциации
α = (i — 1 ) : (n — 1)
Таким образом, для определения степени диссоциации электролита нужно только найти значение коэффициента i для данного раствора, что проще всего осуществить путем измерения понижения точки замерзания (криоскопическим методом). Обратно, зная концентрацию раствора и степень диссоциации растворенного электролита, легко рассчитать (по той же формуле) изотонический коэффициент, а следовательно, и осмотическое давление, а также точки замерзания и кипения раствора.
Пример 1. Раствор, содержащий 8 г NaOH в 1000, г воды, замерзает при —0,677°. Определить степень диссоциации NaOH в этом растворе.
Вычисляем понижение точки замерзания по формуле ∆ t = (K x m):M . Так как молекулярный вес NaOH равняется 40, т — 8 и К = 1,86, то
∆ t = (1,86 x 8) : 40 = 0,372º
Наблюдаемое в действительности понижение точки замерзания ∆ t’ = 0,677°, откуда
i = 0,677 : 0,372 = 1,82
Подставляя значение i в формуле для определения α и принимая во внимание, что NaOH диссоциирует на два иона, получаем:
α = (1,82 — 1) : (2 — 1) = 0,82, или 82%
Пример 2, В децинормальном растворе сернокислый калий диссоциирован на 71%. Каково осмотическое давление растворов при 0°?
Вычисляем теоретическую величину осмотического давления. Децинормальный раствор K2SO4 содержит в литре 1/20 моля. Его осмотическое давление при отсутствии диссоциации должно было бы быть в 20 раз меньше, чем осмотическое давление раствора, содержащего 1 моль в литре. Следовательно,
P = 22,4 : 20 = 1,12 am
По условию задачи, α = 0,71. «Молекула» K2SO4 диссоциирует на три иона, отсюда
0,71 = (i — 1) : (3 — 1) ; i = 2,42
Определив i, находим Р’:
2,42 = Р’ : 1,12 ; Р’ = 2,71 am
На практике степень диссоциации электролитов обычно определяют не криоскопическим, а более простым методом, основанным на измерении электропроводности растворов.
Как известно, электропроводностью раствора называется его способность проводить ток. Между электропроводностью и диссоциацией существует тесная связь. Так как только диссоциированная часть электролита принимает участие в проведении тока, то понятно, что при прочих равных условиях раствор тем лучше будет проводить ток, чем больше молекул диссоциировало на ионы. Поэтому, измерив электропроводность раствора, можно вычислить и степень диссоциации находящихся в растворе молекул. Не имея возможности останавливаться в настоящем учебнике на описании этого метода, отметим лишь, что значения степеней диссоциации различных электролитов, вычисленные по электропроводности растворов, довольно хорошо совпадают с величинами, полученными криоскопическим методом. Это обстоятельство в свое время сильно помогло всеобщему признанию теории Аррениуса.
Пользуясь зависимостью между электропроводностью и степенью диссоциации, легко показать на опыте, что последняя увеличивается с разбавлением раствора.
В прямоугольный сосуд (рис. 77) опустим до дна две длинные медные пластинки, отстоящие одна от другой на несколько сантиметров, и соединим их с полюсами батареи из двух сухих элементов, включив в цепь гальванометр, начала нальем в сосуд дестиллированной воды. Стрелка гальванометра остается в покое, так как вода не проводит тока. После этого через, воронку с длинной трубкой, доходящей до дна сосуда, осторожно прибавим концентрированный раствор едкого натра так, чтобы он расположился тонким слоем на дне сосуда. Находящееся b концентрированном растворе небольшое число ионов Na• и ОН’ заполняет тот не проводящий промежуток, который существовал в цепи, и стрелка гальванометра несколько отклоняется, указывая на наличие тока. Будем теперь осторожно размешивать жидкость в сосуде. Отклонение стрелки постепенно увеличивается, указывая на увеличение электропроводности; стрелка перестает отклоняться лишь тогда, когда жидкость сделается однородной. Так как при перемешивании жидкости количество едкою натра между электродами остается неизменным, то с точки зрения теории Аррениуса увеличение электропроводности вызывается увеличением числа ионов в растворе. Таким образом, степень диссоциации едкого натра растет с разбавлением раствора.
Вы читаете, статья на тему Степень диссоциации


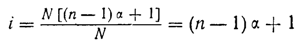
Добавить комментарий
Для отправки комментария вам необходимо авторизоваться.