Силы Ван дер Ваальса представляют собой межмолекулярные (и межатомные) взаимодействия, обладающие энергией приблизительно 10—20 кДж/моль.
В современном научном контексте эти силы часто ассоциируются с поляризацией молекул и возникновением дипольных моментов. Они были впервые описаны Й. Д. Ван дер Ваальсом в 1869 году.
Эти взаимодействия между атомами инертных газов делают возможным существование различных агрегатных состояний, таких как газ, жидкость и твердые тела.
Они называются взаимодействия между постоянными и индуцированными диполями.
Это название возникло из необходимости учета поправки на внутреннее давление в уравнении состояния реального газа, предложенном Ван дер Ваальсом.
Эти силы, включая водородные связи, играют ключевую роль в формировании трехмерной структуры биологических макромолекул.
Кроме того, эти силы возникают как между молекулами, так и между частицами, охватывая как макроскопический, так и наноразмерный уровни.
Силы Ван дер Ваальса в газах
Двухатомная молекула фтора не образует высших соединений (F3, F4, . . .), так как каждый атом фтора имеет только одну частично заполнен валентную орбиту.
Оба ядра в молекуле F2 окружены таким число, электронов, которого достаточно для заполнения валентных орбит.
В подобных условиях двухатомная молекула ведет себя по отношению к другим таким же молекулам подобно атому инертного газа.
Поэтому конденсацию молекулярного фтора при 85° К вызывают те же самые силы, что и в случае инертного газа.
Эти силы называются вандерваальсовыми силами (по имени голландского ученого Ван дер Ваальса).
Объяснение действия вандерваальсовыми силами
Если внешние орбиты всех атомов в молекулах заполнены (образуется электронная конфигурация инертного газа), то электроны другой молекулы не могут близко подойти к ядрам.
При сближении таких молекул энергия уменьшается только на несколько тысячных долей килокалории на моль.
Таким слабым взаимодействием характеризуются вандерваальсовы силы.
Мы теперь имеем простое правило для того, чтобы предсказать, в каком случае данный элемент образует слабо связанную молекулярную жидкость и низкоплавкие кристаллы.
Если элемент образует молекулу, в которой каждый атом приобретает электронную конфигурацию инертного газа, то среди таких молекул существует только вандерваальсово взаимодействие.
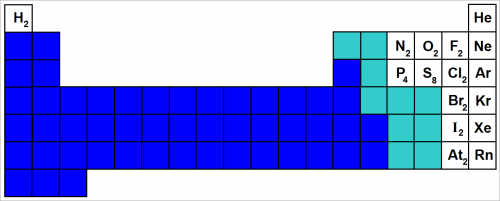
Это элементы, образующие жидкости и твердые вещества вандерваальсова типа, сосредоточены в верхнем правом углу периодической таблицы (см. рис.).
Эти элементы образуют устойчивые молекулы, в которых полностью использована способность каждого атома к образованию связей.
Силы ван-дер-ваальса это простыми словами
Это слабые взаимодействия между молекулами, которые играют ключевую роль в различных физических и химических процессах.
Эти силы возникают из-за временных флуктуаций распределения электронов вокруг атомов, что приводит к образованию кратковременных диполей.
В результате молекулы могут притягиваться друг к другу, даже если они не имеют явного зарядного распределения.
Существуют разные виды сил ван-дер-ваальса, включая дисперсионные силы, которые действуют между любыми молекулами, и силы диполь-диполь, которые проявляются между полярными молекулами.
Эти взаимодействия отвечают за многие свойства веществ, такие как температура кипения и растворимость.