Растворимость
[no_toc]
Поэтому численно растворимость может быть выражена теми же способами, что и концентрация, например в процентах растворенного вещества или в молях на 1 л раствора. Очень часто растворимость выражают также числом граммов вещества, растворяющихся в 100 г растворителя.
Растворимость различных веществ в воде колеблется в широких пределах. Если в 100 г воды при комнатной температуре растворяется более 10 г вещества, то такое вещество принято называть легко растворимым; если растворяется менее 1 г вещества — труднорастворимым и, наконец, практически нерастворимым, если в раствор переходит менее 0,01 г вещества. Абсолютно нерастворимых веществ не существует.

Зависимость растворимости от температуры
С повышением температуры растворимость почти всех твердых веществ увеличивается.
Так, например, в 100 г воды могут растворяться следующие количества калийной селитры:
Температура в °С. . . . 0 20 40 60 80 100
Растворимость в г ….. 13,5 31,5 64 110 169 247
Изменение растворимости с повышением температуры обычно происходит неравномерно и для каждого вещества различно.
Зависимость между растворимостью и температурой очень удобно изображать графически. На рис. 3 приведено несколько характерных кривых растворимости. Резко поднимающиеся вверх кривые растворимости калийной селитры KNO3, азотнокислого свинца Pb(NO3)2 и азотнокислого серебра AgNO3 показывают, что с повышением температуры растворимость этих веществ быстро увеличивается.
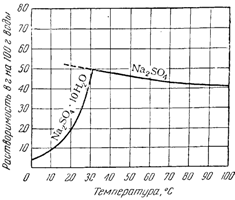
Наоборот, растворимость хлористого натрия лишь незначительно изменяется по мере повышения температуры, что показывает почти горизонтальная кривая растворимости этой соли. Более сложный вид имеет кривая растворимости сернокислого натрия (рис. 4 ). До 32° эта кривая круто поднимается кверху, указывая на быстрое увеличение растворимости.

При 32° происходит резкий излом кривой, после чего она идет несколько вниз. Следовательно, сернокислый натрий обладает наибольшей растворимостью при 32°.
Растворение жидкостей в жидкостях
Жидкости также могут растворяться в жидкостях. Некоторые из них неограниченно растворимы одна в другой, т. е. смешиваются друг с другом в любых пропорциях, как, например, спирт и вода, другие — взаимно растворяются лишь до известного предела.
Так, если взболтать эфир с водой, то образуется .два слоя: верхний представляет собой насыщенный раствор воды в эфире, а нижний — насыщенный раствор эфира в воде. В большинстве подобных случаев с повышением температуры взаимная растворимость жидкостей увеличивается до тех пор, пока не будет достигнута температура, при которой обе жидкости смешиваются в любых пропорциях.
Растворение газа в жидкостях
В отличие от твердых веществ и жидкостей растворимость газов с повышением температуры уменьшается. Если оставить в теплой комнате стакан с холодной водой, то внутренние стенки его покрываются пузырьками газа — это воздух, который был растворен в воде, выделяется из нее вследствие нагревания. Кипячением можно удалить из воды весь растворенный в ней воздух (поэтому кипяченая вода имеет иной вкус, чем сырая).
Кроме температуры, на растворимость газов уходящих из раствора в единицу времени, тоже будет расти, пока, наконец, не сравняется со скоростью растворения. Тогда установится состояние равновесия, т. е. жидкость станет насыщенной газом.
газ над жидкостью ⇄ газ растворенный
Если теперь увеличить давление газа, например, в два раза, то во столько же раз увеличится и концентрация его молекул над жидкостью, а следовательно, и скорость растворения газа.
Равновесие нарушится. Чтобы при новом давлении снова установилось равновесие, концентрация растворенных молекул, очевидно, тоже должна увеличиться вдвое.
Таким образом, мы приходим к выводу, который известен под названием закона Генри:
Закон Генри для растворенного в жидкости газа
Весовое количество газа, растворенного в данном объеме жидкости, прямо пропорционально давлению газа .
Например, в 100 мл воды при 0° и нормальном давлении растворяется 0,335 г углекислого газа, а при увеличении давления вдвое — 0,670 г. Но так как пропорционально давлению увеличивается и плотность газа, то эти 0,670 г будут занимать при удвоенном давлении такой же объем, как 0,335 г при нормальном давлении.
Следовательно:объем газа, растворяющегося в данном объеме жидкости, не зависит от давления. Поэтому растворимость газов обычно выражают не в граммах, а в миллилитрах, указывая объем паза, растворяющийся при данной температуре в 100 мл растворителя.
Растворимость некоторых газов в воде при 0° и при 20° приведена в табл.
Если над жидкостью находится смесь нескольких газов, то растворимость каждого из них определяется не общим давлением смеси, а парциальным давлением растворяющегося газа. Это большое влияние оказывает давление, при котором находится газ.
Молекулы газа, находящегося над жидкостью в закрытом сосуде, бомбардируют поверхность жидкости и растворяются в жидкости со скоростью, пропорциональной концентрации газа. Перешедшие в раствор молекулы, в свою очередь, время от времени ударяются о поверхность жидкости изнутри и вылетают наружу.
По мере того как в результате растворения концентрация растворенных молекул будет увеличиваться, скорость их выделения, т. е число молекул, обстоятельство необходимо учитывать при расчете растворимости газов, находящихся в смеси с другими газами.
Пример расчета растворимости газа в жидкости
Положим, например, что требуется рассчитать состав растворенного в воде воздуха. Если принять округленно, что атмосферный воздух содержит по объему 1/5 часть кислорода и 4/5 части азота, то при общем давлении в 1 ат парциальное давление кислорода будет равно 0,2 ат, а азота — 0,8 ат.
При нормальном давлении и температуре 20° в 100 мл воды растворяется 3,1 мл кислорода и 1,54 мл азота. Следовательно, при давлении 0,2 ат должно раствориться 3,1 • 0,2 = 0,62 мл кислорода, измеренных при давлении в 1 ат; азота же при давлении 0,8 ат должно раствориться 1,54 • 0,8 — 1,232 мл. Таким образом растворенный в воде воздух будет содержат приблизительно 33%.
Растворимость газов в воде кислорода, т. е значительно больше, чем атмосферный воздух.
Растворы газов в жидкостях следует хранить в герметически закупоренных склянках, так как иначе нельзя будет поддерживать над жидкостью то давление, при котором происходило ее насыщение газом : из открытой склянки газ диффундирует в воздух, давление его падает и растворенные молекулы газа постепенно выделяются из раствора.
Вы читаете, статья на тему Растворимость


Добавить комментарий
Для отправки комментария вам необходимо авторизоваться.