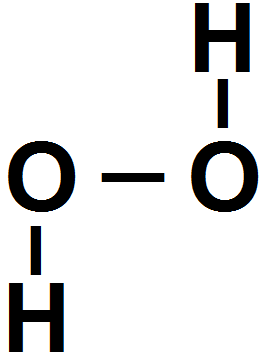Образование связи между атомами является основополагающим процессом в химии, определяющим структуру и свойства веществ.
Эта связь возникает в результате взаимодействия электронов внешних оболочек атомов.
Существует несколько типов химических связей:
- Ковалентные.
- Ионные.
- Металлические.
Ковалентные связи образуются, когда два атома делятся парами электронов, что позволяет им достичь стабильной электронной конфигурации.
Ионные связи возникают, когда один атом передает электрон другому, создавая положительные и отрицательные ионы, которые притягиваются друг к другу.
Металлические связи характеризуются общей «электронной оболочкой», где электроны свободно движутся между атомами, что придаёт металлам их уникальные свойства.
Периодичность в химических формулах характерна и для второго периода периодической таблицы.
Образование связи между атомами элементов второго периода
Способность к образованию химических связей атомами лития Li, бериллия Be, бора B, кислорода O, азота N, фтора F и углерода C является ключевым аспектом их химической природы.
Эти элементы, имея соответствующее расположение валентных электронов, способны образовывать устойчивые молекулы, которые лежат в основе многих органических и неорганических соединений.
Кислород, будучи двухвалентным, формирует прочные связи в молекуле воды и участвует в образовании других важных веществ, таких как перекись водорода, демонстрируя свою реакционную способность и уникальные свойства.
Азот, с его тремя валентными электронами, создаёт устойчивые соединения, например, аммиак, подтверждая свою важную роль в биохимии и промышленной химии.
Углерод, обладая способностью к четырёхвалентному связыванию, открывает бесконечные возможности для формирования разнообразных органических молекул.
Способность к образованию связей атомами кислорода
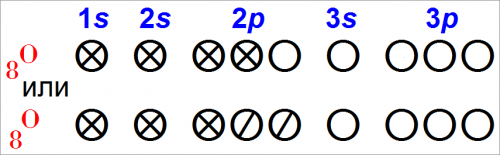
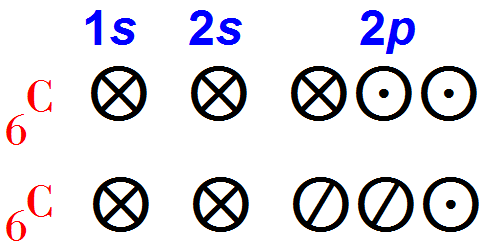
Нейтральный атом кислорода имеет восемь электронов. Шесть из них расположены на 2s— и 2р-орбитах и являются гораздо более подвижными, чем остальные два электрона, занимающие 1s-орбиту.
Следовательно, кислород имеет шесть валентных электронов, 2s— и 2р-орбиты — это валентные орбиты.
Валентные электроны могут располагаться на этих орбитах двояко рис. 1:
Вспомним пространственную конфигурацию р-орбит. Каждая из них направлена вдоль одной их трех осей координат.
Если электроны расположены на орбитах, как показано на схеме (рис. 1, 1), то два электрона занимают р-орбиту, направленную вдоль оси х (px), а два других — р-орбиту, направленную вдоль оси у (ру).
Если же электроны распределены, как показано на схеме (рис. 1, 2), то два электрона находятся на рx-орбите, только один электрон — на ру-орбите и последний — на рz-орбите.
Таким образом, расположение электронов (рис. 1, 2) отличается от (рис. 1, 1) перемещением одного электрона с ру-орбиты в другую часть пространства — на рz-орбиту.
Поскольку электроны отталкивают друг друга, мы можем ожидать, что конфигурация (рис. 1, 2), при которой электроны расположены дальше друг от друга, будет обладать меньшей энергией.
Опыты показывают, что это действительно так, поэтому все рассуждения мы будем строить на основе конфигурации электронов атома кислорода (рис. 1, 2). Однако конфигурация (рис. 1, 1) также встречается в химии атомов кислорода.
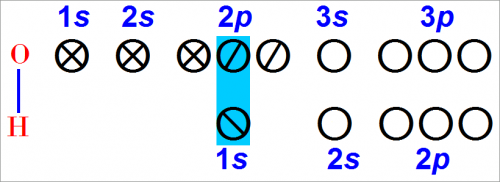
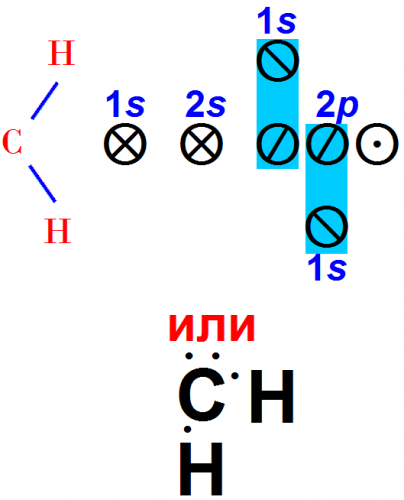
Предположим, к атому кислорода в наиболее устойчивом состоянии (рис. 1, 2) приближается атом водорода. Каждый атом имеет частично заполненные валентные орбиты.
Может произойти обобщение электронов атомов кислорода и водорода, для которого характерно размещение электронов вблизи обоих ядер одновременно.
Следовательно, может образоваться устойчивая связь:
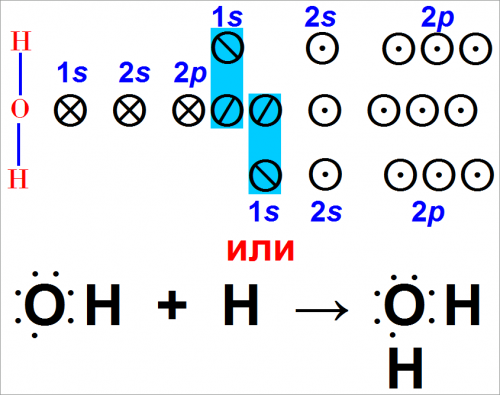
В обоих случаях изображения связи [(рис. 3, 1) и (рис. 3, 2)] мы видим, что частица ОН способна к дальнейшему образованию связи. В уравнении (рис. 3, 1) на третьей 2р-орбите располагается один электрон, а могут находиться два. Это значит, что может образоваться еще одна связь.
В уравнении (рис. 3, 2) расположение электронов около атома кислорода указывает, что их только семь. Атом кислорода будет более устойчив, если он присоединит еще один электрон.
В таком случае мы делаем вывод, что OH может реагировать с другим атомом водорода.
Эта реакция записывается следующим образом:
Так мы получили соединение Н2О. По любому способу изображения способность к образованию связей атома кислорода исчерпывается лишь в том случае, когда образуются две связи.
Иначе говоря, кислород двухвалентен, а соединение Н2О очень устойчиво. Все атомы в молекуле Н2О имеют заполненные валентные орбиты вследствие обобщения электронов.
Реакция между двумя молекулами ОН. Хотя частица ОН реакционно способна, эта группа атомов достаточно устойчива, и ее можно считать молекулой.
Например, она существует в условиях многих высокотемпературных пламене. Можно ожидать, что ее химические свойства сходны свойствами атома фтора.
Сравните их электронные формулы:
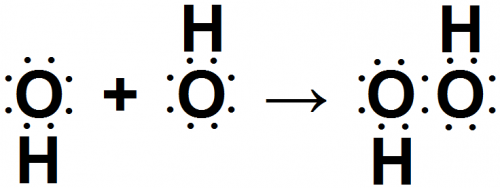
Поскольку два атома фтора реагируют друг с другом, образуя ковалентную связь, вероятно, две молекулы ОН могут реагировать таким же путем:
В результате реакции (рис. 5) образуется соединение Н2О2. Это формула хорошо известного вещества — перекиси водорода.
На основании подобных рассуждений об образовании химических связей мы видим, что в молекула Н2О2 должна существовать кислород-кислородная связь:
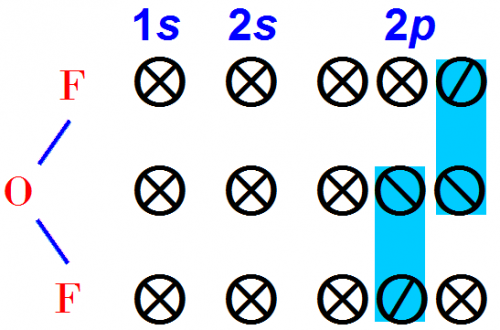
Соединения кислорода с фтором. Нетрудно предсказать, что кислород будет образовывать с двумя атомами фтора устойчивое соединение F2O.
Электроны распределяются по орбитам следующим образом:
Электронная формула имеет вид:
Мы снова установили, что кислород двухвалентен.
Способность к образованию связей атомами азота
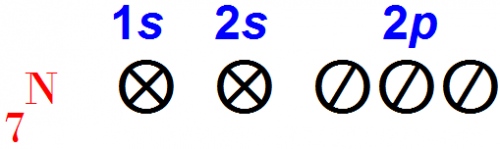
По той же причине, которая была указана для атомов кислорода атом азота наиболее устойчив, когда он имеет максимальное число частично заполненных валентных орбит.
В таком состоянии электроны находятся на максимальном расстоянии друг от друга.
Наиболее устойчивое состояние атома азота следующее:
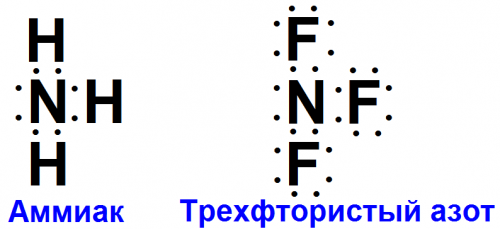
Теперь нетрудно предсказать, что азот будет образовывать с водородом устойчивое соединение NH3.
Следовательно, азот трехвалентен Аналогичное соединение, NF3, он образует с фтором. Электронные формулы таковы:
Способность к образованию связей атомами углерода
У атома углерода электроны распределяются на орбитах следующим образом:
Сначала сравним распределение электронов (рис. 11, 1) и (рис. 11, 2). Если учесть, что элекроны взаимно отталкиваются, то конфигурация (рис. 11, 2) должна быть устойчивой, чем (рис. 11, 1). Кроме того, на схеме (рис. 11, 2) электроны размещаются по одному на рх— и ру-орбитах, в то время как на схеме (рис. 11, 1) оба электрона находятся на одной и той же рх-орбите. Экспериментально установлено, что конфигурация (рис. 11, 2) более устойчива, чем (рис. 11, 1).
Теперь мы можем предсказать химические свойства атома углерода в этом состоянии.
Он должен быть двухвалентным, например в соединениях СН2 и CF2.
Рассмотрим одно из них, скажем, СН2:
После использования двух имеющихся частично заполненных орбит на образование ковалентных связей с атомами водорода остается свободная валентная орбита.
По электронной формуле (рис. 12, 2) мы видим, что около атома углерода в СН2 находится только шесть электронов. На валентных орбитах могут разместиться восемь электронов.
Поскольку одна валентная орбита в СН2 полностью свободна, можно ожидать, что соединение СН2 реакционноспособно.
Считается, что СН2 и CF2 — устойчивые, но очень реакционноспособные молекулы.
Хотя имеется ряд экспериментальных доказательств существования СН2 и CF2, получить эти вещества в чистом виде невозможно.
Такая высокая реакционная способность показывает, что энергетически более выгодно использовать все четыре валентные орбиты, если это возможно.
Таким образом, имеется еще один способ распределения электронов на орбитах.
При таком распределении электронов атом углерода имеет четыре наполовину заполненные валентные орбиты.
Состояние менее устойчиво, чем (рис. 11, 2), так как один электрон переходит с 2s-уровня энергии на несколько более высокой 2р-уровень энергии. Этот процесс называется (проматыванием) электрона.
С другой стороны, энергия активирования не очень велика, и благодаря этому атом углерода приобретает способность к образованию четырех ковалентных связей.
Каждая ковалентная связь увеличивает устойчивость на большую величину, чем просто для компенсации энергии, затраченной на активирование одного из 2s-электронов.
Атом углерода может обобщить электроны, например, с четырьмя атомами водорода или четырьмя атомами фтора. Следовательно, углерод четырехвалентен.
Способность к образованию связей атомами бора
Атом бора имеет две возможности для распределения электронов, как и атом углерода.
Это необходимо для перехода электрона с 2s-орбиты на 2р-орбиту, чтобы ась электронная конфигурация. В результате у атома бора появляется дополнительная способность к образованию связи.
В то время как в состоянии атом бора может образовать лишь одну ковалентную связь, в другом состоянии он может образовать три связи.
Поскольку каждая новая связь понижает энергию, все химические свойства бора обусловлены электронной конфигурацией.
Можно ожидать, что бор трехвалентен. Мы предполагаем, что должны существовать такие молекулы, как ВН3 и BF3.
Однако мы не можем не отметить, что в этом случае остается одна полностью свободная валентная орбита.
Последняя свободная 2р-орбита остается такой же, как и в случае СН2. Поскольку молекула СН2 очень реакционноспособна, молекула BH3 будет такой же.
Это действительно так. Имеется лишь косвенное доказательство существования ВН3.
Вместо этого соединения бор образует с водородом ряд необычных соединений, простейшее из которых — В2Н6 — называется дибораном.
Объяснить эту структуру на основе таких простых представлений, о которых мы только что упоминали, нельзя.
Бор — «двойственный» элемент.
С одной стороны, одна из незаполненных валентных орбит должна оказывать влияние на его способность к образованию связей, о чем свидетельствует реакционная способность ВН3.
С другой стороны, бор образует в соответствии с электронной конфигурацией трехвалентные соединения.
BF3 — устойчивое газообразное соединение, которое в противоположность ВН3 легко выделяется в чистом виде.
Объяснение, почему атомы фтора могут образовывать устойчивое соединение с атомами бора, несмотря на свободную 2р-орбиту, а атомы водорода — нет, будет дано позднее.
Нас же интересует пока то, что BF3— наиболее устойчивое соединение бора с фтором и что это свидетельствует о способности бора находиться в трехвалентном состоянии.
Способность к образованию связей атомами бериллия
Атом бериллия, так же как и атомы бора и углерода, способен активировать электрон, чтобы он мог участвовать в образовании большего числа химических связей.
бериллий «страдает» тем же недостатком, что и бор, только в удвоенном размере. Он имеет две свободные валентные орбиты.
В результате молекулы ВеН2 и BeF2 как таковые могут быть получены лишь при очень высоких температурах (выше 1000° К).
При более низких температурах эти свободные валентные орбиты способствуют конденсации молекул в твердое вещество, в котором эти орбиты могут участвовать в образовании химических связей.
Образование связей атомами лития
Об образовании связей атомом лития можно сказать мало нового. Имея только один валентный электрон, он может образовывать газообразные молекулы LiH и LiF.
Можно ожидать, что из-за наличия свободных валентных орбит эти вещества будут существовать только при очень высоких температурах.
Это согласуется с фактами, как видно из таблице, в которой указаны формулы, температуры плавления и температуры кипения устойчивых фторидов элементов второго периода.
Таблица фториды элементов второго периода периодической таблицы
| Элементы | Li | Be | 8 | С | N | 0 | P |
| Формула фторида | LiF | BeF3 | BF3 | cf3 | NF3 | F2O | F2 |
| Температура плавления, °К | 1143 | 1073 | 146 | 89 | 56 | 49 | 50 |
| Температура кипения, °К | 1949 | — | 172 | 145 | 153 | 128 | 85 |
В каждом случае приведенная в таблице формула соответствует веществу, существующему в газовой фазе.
Валентность
Очень часто при обсуждении природы химических связей употребляют слово «валентность». К сожалению, это слово используется для обозначения многих совершенно различных вещей.
Иногда валентность применяют для обозначения заряда иона, иногда — общего числа атомов, с которыми данный атом будет связан, а в других случаях — для обозначения средней степени окисления
Согласно наиболее общепринятому определению, валентность — это число атомов водорода, которое может присоединить данный атом или которое выделяется при химической реакции.
Ясно, что слово, имеющее несколько значений, может затруднять обсуждение образования химических связей.
По этой причине мы избегали и будем продолжать избегать употребления этого слова.
Однако мы дали точное определение понятия «валентные электроны» («наиболее слабо связанные электроны»).
Хотя и с некоторой осторожностью, мы применяем также термин «валентные орбиты», обозначающий всю группу орбит с энергией, приблизительно равной энергии орбит, заполненных валентными электронами.
В обоих этих случаях от слова «валентность» производится прилагательное к основному понятию.