Насыщенные ненасыщенные пересыщенные растворы это растворы которые при нормальных условиях обладают определенными для них свойствами.
Повышение или понижение температуры влияет на образование этих растворов, поэтому ввели понятие (при нормальных условиях).
Национальный институт стандартов и технологий США (англ. National Institute of Standards and Technology, NIST) использует температуру +20 °C (293,15 K) и давление 101 325 Па (1 атм).
Примером ненасыщенного раствора может служить моря и океаны, а перенасыщенного озера в которых добывают соль.

Что такое насыщенные ненасыщенные пересыщенные растворы
Насыщенные растворы
Это растворы определенных веществ при растворении которых при нормальной температуре не осталось осадка на дне сосуда и оно больше не растворяется.
Значение насыщенный иногда применяется формально так как существуют и другие его значения (не достаточно насыщенный или недостаточно пересыщенный).
Если насыщенный раствор охладить то образуется пересыщенный раствор для данной температуры, а если нагреть то раствор станет ненасыщенный так как он растворить какое то количество вещества.
Пример получения насыщенного раствора
Для образования насыщенного раствора нужно взять 34,4 г соли хлорида калия KCl и растворить его при температуре (20 °С) в в 100 гр. воды.
Балас температуры приведет к тому, что хлорид калия будет больше растворяться в воде, а понижение температуры приведёт к тому, что некоторая соль выпадет в осадок или на стенки сосуда.
Иногда такое свойства некоторых солей применяется для их получения из комплекса солей, примером служит получение хлората калия.
Ненасыщенный раствор
Это раствор в котором при обычной температуре находиться меньше растворенной соли (вещества), чем в в его насыщенном состоянии.
Примером ненасыщенного раствора можно считать реки, моря, океаны, а также вода налитая в стакан так как в воде (растворитель) содержится некоторое количество солей таких как хлорид натрия, хлорид калия и других солей.
Пример получения ненасыщенного раствора
Для того, чтобы получить ненасыщенный раствор нужно при температуре (20 °С) добавить в 100 гр. растворителя (вода) меньше чем 34,4 гр. хлорида калия.
Изменение температуры жидкости может привести к тому, что для данной пониженной температуры образуется насыщенный и даже пересыщенный раствор, но при одном условии если концентрация соли близка к насыщенному раствору.
Пересыщенный растворы
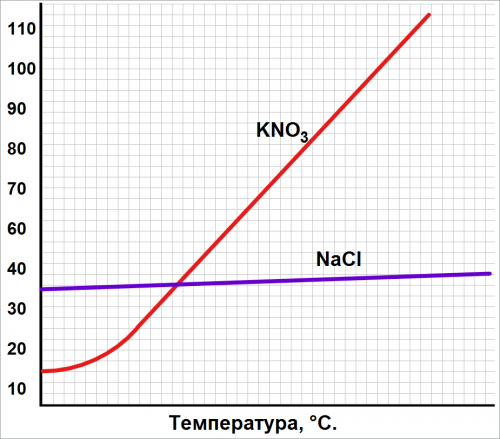
Рис. Зависимость растворение солей от температуры.
Это раствор в котором при обычных условиях растворено больше соли чем этого потребовалось для получения насыщенного раствора.
Примером служат озера в которых хлорид натрия растворен на столько, что образует кристаллы на дне и во круг водоема, некоторые такие водоемы пересохли образовав соленые пустыни (Ую́ни — солончак, высохшее солёное озеро на юге пустынной равнины Альтиплано).
Пример получения пересыщенного раствора
Для этого нужно взять больше чем 34,4 гр. хлорида калия и растворить в горячей воде, если образовался осадок его нужно осторожно отфильтровать, чтобы не было загрязнения раствора.
После остывания при комнатной температуре раствор может находиться долгое время без образования каких либо кристаллов солей на стенках сосуда.
Но если встряхнуть или внести на стеклянной палочке кристалл хлорида калия сразу начнется процесс кристаллизации.
Пересыщенные растворы являются неустойчивыми системами, способными к существованию только при отсутствии в растворе твердых частиц растворенного вещества.
Возможность длительного существования таких растворов объясняется трудностью первоначального возникновения мельчайших «зародышевых» кристалликов.
Так называемых центров кристаллизации, от которых кристаллизация распространяется на всю массу раствора.
Упражнение
Растворы ненасыщенные насыщенные пересыщенные растворимость единицы измерения:
- Граммы вещества на 100 г растворителя (г/100 г).
- Молярная концентрация (моль/л).
- Титр (г/мл).
- Мольная доля (мольн. дол.).
Растворы могут быть классифицированы на ненасыщенные, насыщенные и пересыщенные в зависимости от их концентрации и способности растворять вещества.
Ненасыщенные растворы:
Определение: Это растворы, в которых растворитель способен растворять еще большее количество растворенного вещества при данной температуре.
Они содержат меньшее количество растворенного вещества, чем максимально возможное.
Пример: Если в воде растворено 5 г соли при температуре 20°C, и растворимость соли составляет 10 г/100 мл, то раствор будет ненасыщенным.
Насыщенные растворы:
Определение: Это растворы, в которых растворитель содержит максимальное количество растворенного вещества, которое он может растворить при данной температуре.
В этих растворах находится равновесие между растворением и осаждением вещества.
Пример: Если в воде растворено 10 г соли при температуре 20°C, и растворимость соли составляет 10 г/100 мл, то раствор будет насыщенным.
Пересыщенные растворы:
Определение: Это растворы, содержащие больше растворенного вещества, чем позволяет растворимость при данной температуре.
Такие растворы нестабильны, и любое небольшое возмущение может привести к кристаллизации лишнего вещества.
Пример: Если в воде растворено 12 г соли при температуре 20°C, и растворимость соли составляет 10 г/100 мл, то раствор будет пересыщенным.

Добавить комментарий
Для отправки комментария вам необходимо авторизоваться.