Основы классификации органических соединений
Современная классификация органических соединений основывается на следующих положениях теории химического строения:
1. Атомы в молекулах соединены друг с другом в определенной последовательности. Изменение этой последовательности приводит к образованию нового вещества с новыми свойствами.
2. Соединение атомов происходит в соответствии с их валентностью. Валентности всех атомов в молекуле взаимно насыщены. Свободных валентностей у атомов в молекулах не остается.
3. Свойства веществ зависят от их «химического строения», т. е. от порядка соединения атомов в молекулах и характера их взаимного влияния. Наиболее сильное влияние оказывают атомы, непосредственно связанные друг с другом. Поэтому молекулы, имеющие одинаковые группировки атомов, обладают сходными свойствами.
4. Углерод — четырехвалентный элемент. Каждый атом углерода имеет четыре единицы валентности, за счет которых он может присоединять к себе другие атомы или атомные группы, как, например, Н, Сl, ОН, NO2, NH2, CN и т. д.
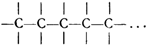
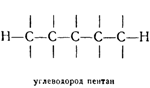
5. Атомы углерода способны соединяться друг с другом, образуя «цепи» атомов или «углеродный скелет» молекулы.
Отмечая валентные связи атомов углерода черточками и имея в виду физический смысл этого обозначения, можно изобразить простейшую цепь следующим образом:
Свободные единицы валентности затрачиваются на присоединение других атомов или атомных групп. Например:
Наряду с простыми цепями, подобными приведенной выше, встречаются и разветвленные цепи. Например:
Кроме «открытых» цепей, существуют также «замкнутые» цепи, в которых атомы углерода связаны друг с другом так, что образуют кольцо, или «цикл». Например:
К кольцам, в свою очередь, могут примыкать открытые цепи и другие кольца. Наконец, атомы углерода могут затрачивать на взаимную связь друг с другом не одну, а две или три единицы валентности. Тогда получаются цепи с «двойными» или «тройными» связями, простейшие из которых можно изобразить следующим образом:
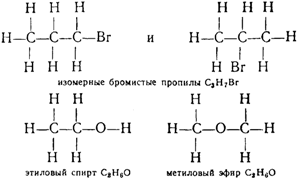
Образованием различных цепей, состоящих из одного и того же числа атомов углерода, а также различным положением других атомов в молекулах одинакового состава и объясняются многочисленные случаи изомерии органических соединений. Для иллюстрации приведем структурные формулы двух пар изомерных соединений:
Изомерия может быть вызвана не только различным порядком сцепления атомов, но и различным их пространственным расположением. Дело в том, что ковалентные связи атомов имеют вполне определенное направление в пространстве. В случае образования атомом углерода простых связей они направлены под углом 109°28′ друг к другу так, как если бы атом углерода находился в центре тетраэдра, а соединенные с ним атомы — в углах тетраэдра На рис. 110 изображена тетраэдрическая модель простейшего соединения углерода с водородом — метана.
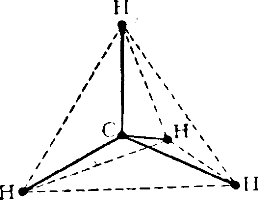
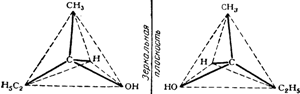
Если с атомом углерода связано четыре разных атома или группы атомов, то возможно образование молекул с двумя различными конфигурациями, как это представлено на рис. 111. Изображенные на нем модели невозможно совместить в пространстве; они отображают конфигурацию молекул двух различных веществ, отличающихся друг от друга некоторыми физическими свойствами. Легко видеть, что одна модель является зеркальным изображением другой.
Если атомы углерода соединены двойной связью, то они лежат в одной плоскости, а остальные связи расположены в той же плоскости под углом 120° друг к другу:
В том случае, когда с каждым из атомов углерода связаны два различных атома или радикала, возможна так называемая геометрическая или цис-транс-изомерия. Примером может служить дихлорэтилен:
В молекулах одною изомера атомы хлора расположены по одну сторону от линии двойной связи, а в молекулах другого изомера — по разные стороны. Первая конфигурация называется цис-конфигурацией, вторая—транс-конфигурацией. Цис- и транс-изомеры отличаются друг от друга по физическим и химическим свойствам.
В соответствии со строением углеродной цепи все органические соединения подразделяются на три большие группы:
1. Соединения с открытой цепью атомов углерода, называемые также ациклическими с о е д и н е н и я м и или с о е д и н е н и я м и жирного ряда, так как к ним относятся жиры и близкие к жирам вещества. В зависимости от характера связей атомов углерода в «цепях» эти соединения делят на предельные, содержащие в молекулах только простые связи, и непредельные, в молекулах которых имеются двойные или тройные связи между атомами углерода.
2. Соединения с замкнутой цепью атомов углерода, или карбоциклические соединения. Эти соединения образуют две подгруппы:
а) соединения ароматического ряда, характеризующиеся наличием в составе их молекулы кольца из шести атомов углерода с особым чередованием простых и двойных связей; такое кольцо находится в молекуле бензола и называется бензольным кольцом;
б) алициклические соединения — все остальные карбоциклические соединения. Алициклические соединения различают по количеству атомов углерода в цикле и по характеру связей между этими атомами.
3. Гетероциклические с о е д и н е н и я. Гетероцикли-ческими называют соединения, кольца которых, кроме атомов углерода, содержат также атомы других элементов (кислорода, азота, серы и т. п.).
При классификации органических соединений за основные вещества принимают вещества, относящиеся к классу углеводородов, т. е. соединения, состоящие только из углерода и водорода . Все остальные соединения рассматриваются как происшедшие из углеводородов путем замены в их молекулах части или всех атомов водорода другими атомами или атомными группами. Например, спирты получаются путем замены в молекулах углеводородов одного или нескольких атомов водорода гидроксильными группами ОН. Следовательно, спирты можно рассматривать как гидроксильные производные углеводородов. Например:
Группы атомов, обусловливающие общие химические свойства веществ, принадлежащих к одному и тому же классу, называются функциональными группами. Гидроксил является функциональной группой спиртов.
Функциональной группой нитросоединений является группа NO2 (нитрогруппа), функциональной группой первичных аминов — группа NH2 (аминогруппа) и т. д.
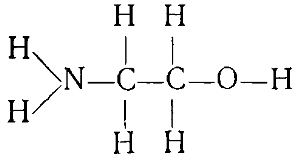
Если в молекуле вещества имеется несколько различных функциональных групп, то такое вещество называется соединением с о смешанными функциями. Примером веществ такого типа может служить аминоэтанол, относящийся к классу аминоспиртов:
Амжюспирты проявляют свойства, присущие и аминам »и спиртам, но и те и другие свойства несколько видоизменены вследствие влияния друг на друга функциональных групп.
Классы органических веществ весьма разнообразны, и в курсе общей химии мы можем вкратце остановиться лишь на важнейших из них.
Вы читаете, статья на тему Основы классификации органических соединений



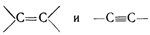

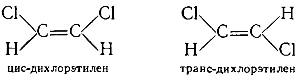

Добавить комментарий
Для отправки комментария вам необходимо авторизоваться.