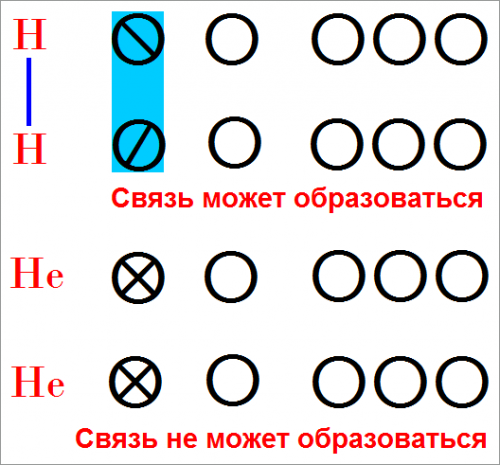
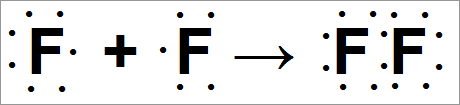Химические связи образуются, если валентные электроны могут быть обобщены двумя атомами с частично заполненными орбитами.
Для этого есть система записи, которая помогала бы в использовании этого правила. Такая система называется изображение химической связи.
Изображение химической связи с помощью орбит
Правило об образовании ковалентной связи можно применять и при изображении связей с помощью орбит:
По этому изображению нет необходимости рассматривать группы орбит со следующим более высоким значением энергии — 2s— и 2р-орбиты.
Для водорода и гелия эти орбиты соответствуют гораздо более высоким значениям энергии и могут вызвать лишь очень слабое притяжение.
Изображение химических связей с помощью электронов.
Обобщение электронов можно показать, представив валентные электроны в виде точек, расположенных между атомами:
Н • + Н • → Н : Н
Мы будем изображать связи с помощью и орбит, и электронов.
Химическая связь в молекуле фтора
Фтор при нормальных условиях температуры и давления представляет собой газ.
Опыты по определению плотности этого газа показали, что молекула фтора состоит из двух атомов.
Между двумя атомами фтора существует химическая связь.
Изображение химической связи в молекуле фтора с помощью орбит
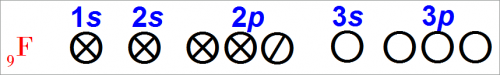
У атома фтора электроны распределяются на орбитах следующим образом:
Мы видим, что нейтральный атом фтора имеет семь валентных электронов, т. е. семь электронов расположены на наиболее отдаленных от центра частично заполненных орбитах.
Эта группа уровней энергии — валентные орбиты — содержит на один электрон меньше, чем это возможно
Следовательно, фтор может обобщить один электрон и объединиться с другим атомом, который имеет такую же возможность.
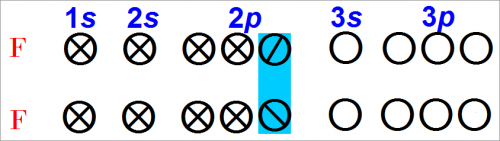
Если приближается другой атом фтора, то они могут обобщить пару электронов и образовать ковалентную связь.
Например:
После того как второй атом приблизится и обобщит свой электроне электроном первого атома у каждого атома фтора целиком заполняются все валентные орбиты.
Для образования дополнительной связи не остается никакой возможности.
Следовательно, молекула фтора F2 не может при соединить третий или четвертый атом с образованием F3, F4 и т. д.
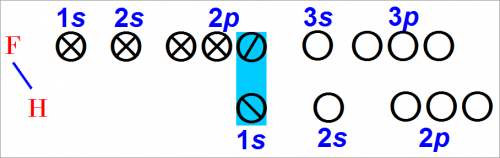
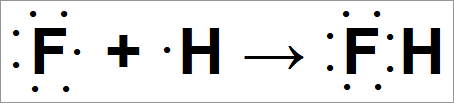
Рассмотрим возможность образования связи при столкновении атома фтора с атомом водорода.
Атом фтора снова может обобщить электроны со вторым атомом, имеющим частично заполненную валентную орбиту:
Теперь у фтора после образования обобщенной пары электронов с атомом водорода «заполнены» все его валентные орбиты.
Дополнительная связь не может образоваться.
То же самое справедливо и для атома водорода, так как у этого атома существует лишь одна валентная орбита — 1s-орбита.
Поскольку ни у одного из атомов не остается частично заполненных валентных орбит, другая связь не может возникнуть, и образуется устойчивое соединение HF.
В обоих случаях образования связи в молекулах мы установили, что атом фтора образует одну связь — в молекуле F2 со вторым атомом фтора, а в молекуле HF с атомом водорода.
Возможность образования одинарной связи говорит о том, что фтор одновалентен.
Изображение связи в молекуле фтора с помощью электронов
При обозначении химической связи с помощью электронов необходимо показывать только валентные электроны.
В атоме фтора их семь — пара электронов на 1s-орбите настолько прочно связана, что играет незначительную роль в химии фтора.
Реакция между двумя атомами фтора записывается так:
Из уравнения (Рис. 10) следует, что между двумя атомами фтора может образоваться ковалентная связь.
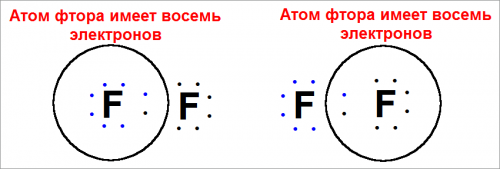
Кроме того, подсчет числа электронов у одного атома фтора или числа электронов, обобщенных с другим атомом фтора, показывает, что валентные орбиты заполнены.
Например, атом фтора, записанный в формуле слева, электростатически притягивает восемь электронов, расположенных рядом справа (рис. 8).
Поскольку восемь электронов — это электроны валентных 2s— и 2р-орбит, каждый атом фтора приобрел энергетически устойчивую конфигурацию инертного газа.
Фтористый водород может быть представлен следующим образом:
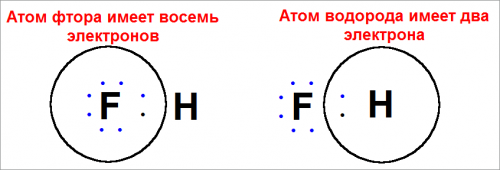
Подсчет числа электронов около каждого атома показывает, что это устойчивая конфигурация.
Поэтому, атом водорода имеет два электрона, а атом фтора — восемь.
Это энергетически выгодно, так атом водорода имеет только одну валентную орбиту — 1s-орбиту. Два электрона заполняют ее полностью.
Мы видим, что связь атома фтора с другим атомом фтора или с атомом водорода можно объяснить образованием обобщенной пары электронов, в результате чего полностью заполняются валентные орбиты.
Такое обобщение электронов делает молекулу F2 (или HF) энергетически более устойчивой, чем отдельные атомы.
Энергетическая устойчивость молекулы обусловлена образованием обобщенной пары электронов, которые одновременно притягиваются обоими положительными ядрами.
Так образуется химическая связь.
Сродство к электрону атома фтора
Опыты показывают, что атом фтора в газовой фазе может присоединять электрон, образуя устойчивый ион F—.
Мы можем говорить об энергии образования этого иона в том же смысле, что и об энергии ионизации.
Энергия однократной ионизации атома фтора — это энергия, необходимая для отрыва электрона от нейтрального атома в газовой фазе.
Обозначим эту энергию E1.
Теплоту реакции можно выразить через E1:
F(г) → F+(г) + е (г)
∆Н = E1 (1)
Энергия двукратной ионизации Е2 относится к реакции:
F+(г) → F2+(г) + е (г)
∆H = Е2 (10)
Теперь мы можем добавить новый процесс, характеризующийся энергией, которую логично обозначить E0
F—(г) → F(г) + е(г)
∆H = Е0 (11)
Сравнивая уравнения (1), (2) и (3), мы видим, что Е0 представляет собой энергию ионизации F— (г).
Но обычно рассматривается реакция, обратная реакции (3).
Теплота реакции (4) по величине равна теплоте реакции (3), но имеет обратный знак:
F(г) + е(г) → F— (г)
∆H = —Е0 (4)
Изменение энергии при реакции (4) называется сродством к электрону атома фтора.
Эта энергия, обозначаемая Е, как уже отмечалось, является отрицательной величиной, если при образовании иона тепло выделяется:
Е = —Е0
Сродство к электрону трудно измерить, и его величина точно известна для небольшого числа химических элементов.
Величина сродства к электрону атома фтора как раз известна:
Е = —83 ккал/моль
или
Е0 = + 83 к.к.ал/моль
Экспериментальные величины, приведенные выше, показывают, что ион F— более устойчив, чем атом фтора и электрон.
Энергетически атом фтора «хочет» присоединить еще один электрон.
Реакцию (4) удобно записать следующей схемой заполнения орбит:
Нейтральный атом фтора имеет семь валентных электронов, т. е. семь электронов занимают частично заполненные орбиты из группы орбит с наиболее высокими уровнями энергии.
Таким образом, эта группа уровней энергии содержит на один электрон меньше, чем это возможно.
Большое сродство к электрону атома фтора показывает, что присоединение этого последнего электрона энергетически выгодно.
Это согласуется с большим числом других опытов, которые показывают, что достигается особая устойчивость электронной конфигурации инертного газа.
Образование молекулы фтора F2
Зная сродство к электрону атома фтора, можно предсказать, что произойдет при столкновении двух атомов фтора. Будет ли происходить реакция.
Одним из факторов, определяющих характер ответа, является энергия.
Рассмотрим реакцию, которая не идет самопроизвольно:
F(г) + F(г) ⇄ F+(г) + F—(г)
Реакцию (5) можно записать в две стадии:
F(г) ⇄ F+(г) + е(г) ∆Н = Е1 = 401,5 ккал/моль (6)
F(г) + е(г) ⇄ F—(г) ∆Н = —E0 = — 83,0 ккал/моль (7)
Суммарная реакция F(г) + F(г) ⇄ F+(г) + F—(г) ∆Н = 318,5 ккал/моль
Мы видим, что реакция (17) энергетически невыгодна.
Выигрыш в энергии при образовании иона F— меньше, чем энергия, необходимая для отрыва электрона от другого атома фтора.
Столкновение двух атомов фтора может привести и к другому результату.
Два атома фтора могут оставаться близко друг к другу, образуя молекулу. Каждый атом имеет валентный электрон на «наполовину заполненной» орбите.
Два атома ориентируются так, что «наполовину заполненные» орбиты перекроются в пространстве.
Затем «наполовину заполненная» валентная орбита первого атома фтора захватит один валентный электрон второго атома фтора.
Таким образом «удовлетворяется» часть электронного сродства первого атома фтора, хотя отрывать электрон от второго атома фтора и не обязательно.
Тем временем второй атом фтора «забирает» такую же часть энергии от валентного электрона первого атома фтора.
Каждый атом фтора присоединяет другой электрон хотя бы на короткое время.
Мы достигли некоторой стабильности реакции (7) без реакции (6).
Максимальное количество энергии, которое может выделиться при таком обобщении электронов, должно быть равно удвоенному сродству к электрону атома фтора:
2 • 83 = 166 ккал.
Но при этом не учитывается работа, затрачиваемая на сближение двух положительных ядер.
Кроме того, мы не можем ожидать, что в условиях обобщения электронов выделится такое же количество энергии, как и при образовании иона F—.
Энергия освобождающаяся при возникновении связи между двумя атомами фтора, равна 36,6 ккал/моль, т. е. составляет заметную долю максимально возможной величины.
Теперь мы можем сказать, почему между двумя атомами фтора образуется химическая связь.
- Во-первых, сродство к электрону атома фтора делает энергетически выгодным присоединение еще одного электрона.
- Во-вторых, два атома фтора могут «использовать» часть этого сродства, обобщая свои валентные электроны.
Все химические связи образуются в результате того, что один, или несколько электронов в молекуле располагаются так, что они испытывают электростатическое притяжение к двум или более положительным ядрам одновременно.