Дисперсия это физический процесс, характеризующийся созданием разделения между фазами или компонентами.
Представляет собой сочетание двух или более фаз, которые имеют тенденцию не смешиваться и оставаться в нереагирующем состоянии друг к другу.
Возможная конфигурация двухфазной системы предполагает, что одна из фаз (дисперсная фаза) находится в виде наносных частиц или мельчайших капель во второй фазе (дисперсионная среда).
При необходимости можно разделить различные фазы физическими методами, такими как центрифугирование, сепарация и т.д.
Обычно дисперсные системы представляют собой коллоидные растворы или золи. Высокомолекулярные растворы также могут быть классифицированы как дисперсные системы, так как они обладают всеми характеристиками таких систем.
Что такое дисперсные системы
Если разболтать в воде мелкий порошок какого-нибудь нерастворимого вещества, например глины, то более крупные частицы вскоре оседают на дно, мелкая же муть держится в воде во «взвешенном» состоянии очень долго, и жидкость иногда остается мутной в течение недель.
Жидкости, в которых взвешены частицы твердого веществ, называются суспензиями.
Если в жидкости находятся во взвешенном состоянии мельчайшие капельки другой жидкости, то такая система носит название эмульсии.
Эмульсию легко получить, сильно взбалтывая с водой какое-нибудь жидкое масло в присутствии веществ, понижающих его поверхностное натяжение.
Обыкновенное молоко представляет собой эмульсию, состоящую из воды, в котором взвешены мельчайшие капельки жира .
Взвешенные в жидкости частицы могут быть отделены от нее фильтрованием.
Обыкновенная фильтровальная бумага задерживает частицы до 5 μ т. е. до 0,005 мм в диаметре, специально приготовленная бумага — до 1μ, а глиняные фильтры задерживают частицы до 0,2 μ.
Пока в жидкости находятся твердые частицы диаметром более 0,1 μ, она представляется не вполне прозрачной и взвешенные частицы могут быть обнаружены в капле жидкости при помощи обыкновенного микроскопа.
Получение коллоидных растворов электричеством
Искусственным путем можно раздробить вещество на такие мелкие частицы, что содержащая их жидкость будет казаться совершенно прозрачной и однородной, хотя в действительности будет неоднородна.
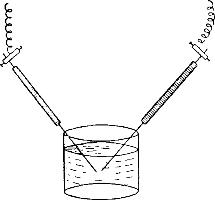
Опустим, например, в дистиллированную воду две серебряные проволочки, соединив их с достаточно сильным источником электрического тока (рис.).
При сближении концов проволочек под водой между ними образуется электрическая дуга и появляются буроватые облачка.
Вскоре вся жидкость, оставаясь совершенно прозрачной, окрашивается в бурый цвет. Эта окраска зависит от мельчайших частичек серебра, распыленных в воде электрической дугой.
Если вместо серебряных проволочек взять золотые, — получается пурпурная жидкость, содержащая распыленные частицы золота.
Полученные таким образом частицы не видны даже при самом сильном увеличении обыкновенного микроскопа, однако их присутствие можно обнаружить при помощи так называемого явления Тиндаля.
Явление Тиндаля
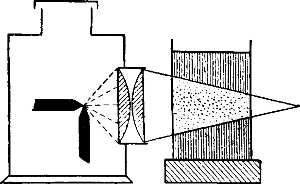
Явление Тиндаля заключается в следующем. Если сквозь жидкость, в которой взвешены мельчайшие частицы, пропустить яркий пучок сходящихся лучей, например из проекционного фонаря, то в жидкости появляется светлый конус, видимый в темном помещении (рис. 2).
Образование светлого конуса объясняется тем, что каждая взвешенная частица рассеивает падающие на нее лучи и таким образом как бы превращается в светящуюся точку, благодаря чему становится виден и весь путь лучей внутри жидкости.
На использовании явления Тиндаля основано устройство прибора, называемого ультрамикроскопом; этот прибор позволяет обнаруживать в жидкости частицы диаметром меньше-0,1 μ, не видимые в обыкновенный микроскоп.
Ультрамикроскоп отличается от обыкновенного микроскопа тем, что свет падает на изучаемую жидкость не снизу, а сбоку.
Если жидкость совершенно однородна, то все поле зрения представляется темным,, так как лучи не проникают в трубку микроскопа.
Но если в жидкости взвешены мелкие частицы, например частицы серебра, распыленного электрической дугой, то рассеиваемые ими лучи попадают в наш глаз, и на темном фоне видны светлые точки, находящиеся в беспорядочном движении (броуновское движение).
Если размеры частиц значительно меньше 0,1 μ, то отдельные частицы перестают быть видимы даже и в ультрамикроскоп, но все еще заметен пучок лучей, проходящих сквозь жидкость.
Наконец, при размерах частиц около 1 mμ светорассеяние становится настолько ничтожным, что исчезает и это явление, и жидкость представляется совершенно однородной или, как говорят, «оптически пустой».
Таковы, например, обыкновенные растворы различных веществ.
Дисперсные системы
Это система, в которой одно вещество является раздробленным и распределенным в виде более или менее мелких частиц в другом веществе, называется дисперсной системой (от латинского dispergere — рассеивать).
Раздробленное вещество называется дисперсной фазой системы; а окружающее его вещество дисперсионной средой.
Так, например, в случае суспензии глины в воде дисперсную фазу образуют частички, глины, а дисперсионной средой является вода.
Дисперсные системы, как мы видели, могут различаться степенью дисперсности. Суспензии и эмульсии принадлежат к грубо-дисперсным системам, так как частицы их дисперсной фазы сравнительно велики.
Наоборот, обыкновенные растворы являются системами с очень высокой, можно сказать, предельной степенью дисперсности, поскольку распределенное вещество раздроблено-до молекул или ионов.
В этом предельном случае уже не приходится говорить о дисперсной фазе, так как весь раствор представляет одну фазу.
Промежуточное положение занимают дисперсные системы, в которых размеры распределенных частиц хотя и больше, чем в обыкновенных растворах, но еще настолько малы, что могут быть обнаружены только при помощи ультрамикроскопа.
Такие системы называются коллоидными растворами или золями.

Ближайшее изучение коллоидных растворов показывает, что между ними и обыкновенными или, как их называют, «истинными» растворами, с одной стороны, и суспензиями или эмульсиями, с другой стороны, нет резкой границы.
Поэтому подразделение дисперсных систем с жидкой дисперсионной средой на три указанных класса является условным.
Границы между этими классами определяются приблизительно пределами видимости в обыкновенный микроскоп и в ультрамикроскоп.
Суспензии и эмульсии содержат частицы, видимые в обыкновенный микроскоп. Диаметр частиц больше 100 mμ (0,1μ). Неоднородность системы обнаруживается невооруженным глазом.
Коллоидные растворы
Диаметр дисперсных частиц лежит в пределах от 100 до 1 mμ. Частицы различимы только в ультрамикроскоп; они беспрепятственно проходят через поры обыкновенных фильтров, но могут быть задержаны перепонками из пергаментной бумаги, бычьего пузыря или специальными «ультрафильтрами».
В проходящем свете коллоидные растворы представляются совершенно прозрачными и однородными, в отраженном свете, особенно если размеры частиц приближаются к 100 mμ,— слегка мутноватыми.
Современные электронные микроскопы, дающие увеличение в десятки и сотни тысяч раз, позволяют не только, обнаруживать коллоидные частицы, но и определять их размеры и форму.
На рис. 3 показан золь серебра, сфотографированный при помощи электронного микроскопа.
Истинные растворы
Диаметр дисперсных частиц меньше 1 mμ. Частицы не могут быть обнаружены оптическим путем.
Расположив жидкие дисперсные системы по степени возрастания дисперсности входящих в их состав твердых или жидких частиц, получим следующий ряд:


Добавить комментарий
Для отправки комментария вам необходимо авторизоваться.