Гидроокиси и их диссоциация
Все кислородные кислоты и все основания можно рассматривать как продукты соединения соответствующих окислов с водой и объединить их под общим названием гидратов окислов или гидроокисей. Например, серную кислоту можно назвать гидроокисью шестивалентной серы, азотную кислоту — гидроокисью пятивалентного азота и т. д.
Принадлежность гидроокиси к классу кислот или к классу оснований определяется тем, на какие ионы она диссоциирует в водном растворе. Если при диссоциации образуются водородные ионы, то мы называем гидроокись кислотой; если же диссоциация идет с отщеплением гидроксильных ионов, то такая гидроокись относится к классу оснований.
В связи с этим различают два типа диссоциации гидроокисей:
кислотный тип диссоциации:
R — O ┼ H ⇄ RO’ + H•
и основной тип диссоциации:
R ┼ O — H ⇄ R• + OH’
Таким образом, при диссоциации гидроокисей разрыв молекулы может происходить или по месту связи кислорода с водородом (кислотный тип диссоциации), или по месту связи элемента R с кислородом (основной тип диссоциации).
Характер диссоциации зависит от положения элемента R в периодической системе, что и определяет относительную прочность связей между этим элементом и кислородом, с одной стороны, и между кислородом и водородом, с другой стороны.
Зная, какими свойствами обладает гидроокись, кислотными или основными, мы соответственно пишем и ее формулу, ставя на первом месте водород, если это кислота, или металл, если это основание. Например: борная кислота изображается формулой Н3ВО3, а не В(ОН)3; гидрат окиси железа — формулой: Fe(OH)3, а не H3FeO3
Кроме кислотных и основных гидроокисей, существуют еще так называемые амфотерные гидроокиси, которые в зависимости от среды ведут себя или как кислоты или как основания. Примером их могут служить Zn(OH)2, Аl(ОН)3 и др., с которыми мы познакомимся при изучении металлов.
Амфотерные гидроокиси взаимодействуют и с кислотами и со щелочами с образованием солей. Так, например, гидрат окиси цинка растворяется в^кислотах, образуя цинковые соли этих кислот:
Zn (ОН)2 + H2SO4 = ZnSO4 + 2Н2O
но тот же гидрат окиси цинка растворяется в щелочах, выступая в данном случае в роли цинковой кислоты H2ZnO2 и образуя ее соли:
H2ZnO2 + 2NaOH = Na2ZnO2 + 2H2O
На практике характер гидроокисей, их принадлежность к тому или иному классу устанавливают или с помощью индикаторов, если гидроокиси растворимы в воде (растворимые кислоты, щелочи) , или в случае нерастворимых гидроокисей — по их отношению к кислотам и щелочам. Гидроокиси-кислоты растворяются в щелочах, но нерастворимы в других кислотах; гидроокиси-основания растворяются в кислотах, но нерастворимы в щелочах, и, наконец, амфотерные гидроокиси растворяются и в кислотах и в щелочах.
Состав любой гидроокиси должен был бы выражаться общей формулой R (ОН) х, где х — валентность элемента R. Однако в тех случаях, когда валентность элемента R больше двух, гидроокиси нередко отщепляют часть воды, переходя в более бедные водой соединения. Например, гидроокись трехвалентного хрома может существовать в виде Сr (ОН) 3.
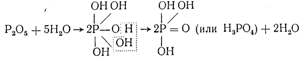
Элементы же с валентностью больше четырех редко образуют гидроокиси с полным числом гидроксильных групп. Так, пятивалентному фосфору должна была бы отвечать гидроокись Р(ОН)5, между тем. наиболее богатая водородом гидроокись фосфора — ортофосфорная кислота содержит только три гидроксильные группы. Образование ее из фосфорного ангидрида Р2О5 и воды можно представить следующим образом:
Опытные данные показывают, что атомы элементов второго периода могут быть химически связаны не более чем с тремя атомами кислорода. Поэтому формула азотной кислоты HNO3 , но не (HO)5N; формула угольной кислоты — Н2СO3, а не (НО)4С
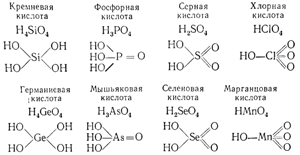
С атомами элементов третьего и четвертого периодов обычно находятся в непосредственной химической связи уже четыре атома кислорода, как это следует из рассмотрения формул соответствующих гидроокисей:
Такие кислоты, как метакремневая Н2SiO3 и метафосфорная НРО3, на первый взгляд представляют исключения из этого правила. Однако приведенные формулы этих кислот являются лишь простейшими и не отображают подлинного состава их молекул, который, по современным данным, отвечает формулам (Н2SiO3)x и (НРО3)х, где х равно трем или больше трех.
Наибольшее число атомов кислорода, которое может быть-сгруппировано около атома элемента пятого периода (в соответствующем его валентном состоянии), равно шести. Примерами, могут служить теллуровая и йодная кислоты:
Таким образом, состав молекул гидроокисей определяется нетолько валентностью элементов (что, в свою очередь, зависит от принадлежности элемента к той или иной группе периодической: системы, но и нахождением элемента в определенном периоде.
Вы читаете, статья на тему Гидроокиси и их диссоциация


Добавить комментарий
Для отправки комментария вам необходимо авторизоваться.