Ван дер Ваальсовы силы это слабые межмолекулярные взаимодействия, которые играют ключевую роль в физике, химии и биологии.
Они возникают из временных колебаний распределения электронов в молекулах, что приводит к образованию мгновенных диполей.
Эти диполи, в свою очередь, могут индуцировать диполи в соседних молекулах, создавая ассоциации, которые называют Ван дер Ваальсовыми силами.
Существуют три основных типа этих сил:
- Дисперсионные силы.
- Диполь-диполярные взаимодействия.
- Водородные связи.
Ван дер Ваальсовы силы, несмотря на свою относительную слабость, оказывают существенное влияние на процессы, такие как растворение, кипение и плавление веществ.
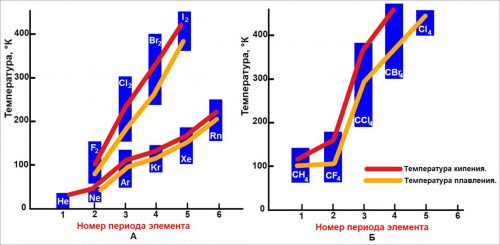
Рисунок. Температуры плавления и температуры кипения некоторых молекулярных соединений и галогенов:
А. инертные газы и галогены; Б —соединения углерода с общей формулой СХ4
Ван дер ваальсовы силы в соединениях и веществах
Чистые элементы могут затвердевать в виде:
- Молекулярных кристаллов.
- Кристаллов с ковалентными связями или металлов.
В этих же формах могут кристаллизоваться и соединения. Кроме того, в случае соединений появляется новая возможность, которая отсутствует у чистых элементов.
Энергия ионизации всех атомов чистых элементов одинакова и электроны распределены равномерно.
В соединениях, где в наиболее устойчивой конфигурации электроны не всегда распределены равномерно по отношению к связываемым атомам, может возникнуть электрический диполь.
Поскольку два связанных атома могут иметь различные энергии ионизации, электроны большую часть времени могут находиться вблизи одного из положительных ядер.
Такое разделение зарядов может привести к возникновению сильных внутримолекулярных сил такого типа который не найден у чистых элементов.
Ван дер ваальсовы силы силы и молекулярные кристаллы
В молекулах соединений возможно разделение зарядов существует много и таких молекул, которые не имеют заметных электрических диполей.
При охлаждении эти молекулы ведут себя, подобно молекулам, построенным из атомов одного и того же элемента.
Если способность к образованию химических связей каждым атомом в молекуле полностью исчерпана, то между молекулами действуют только слабые ван дер ваальсовы силы силы.
Такое слабое взаимодействие являете той низких температур плавления твердых веществ и низких температурах кипения жидкостей, которые сохраняют многие свойства молекул в газообразном состоянии.
При определении ван дер ваальсовых сил особенно важны три фактора:
- Число электронов.
- Размер молекул.
- Форма молекул.
Эти факторы справедливы для элементов и соединений, хотя для соединений возможно большее разнообразие.
Ван дер ваальсовы силы и число электронов
Температуры плавления и кипения инертных газов возрастают с увеличением числа электронов.
То же справедливо для элементов и соединений с ковалентными связями. На рис. такая зависимость представлена графически.
На рис., А показано изменение температур плавления и кипения для инертных газов и галогенов.
На горизонтальной оси отложены номера периодов, которые указывают общее число электронов соответствующих элементов.
На рис., Б представлены данные для соединений с формулой СХ4. На горизонтальной оси тоже отложены номера периодов, но теперь «внешних» атомов X в молекуле СХ4, так как именно эти атомы соприкасаются с соседними молекулами.
Поскольку речь идет о ван дер ваальсовых силах, очень важно, что на поверхности молекулы СВr4 расположены атомы элементов четвертого периода — брома, и менее важно, что центральный атом — углерод— является элементом второго периода.
При определении межмолекулярных сил наибольшее значение имеют «внешние» атомы.
Ван дер ваальсовы силы и размер молекул
Путем сравнения сходных молекул установлено, что большая молекула будет иметь более высокую температуру плавления.
Например, если сравнить метан СН4 и этан С2Н6, внешние атомы у которых одинаковы (атомы водорода), то можно заметить, что температура кипения этана (185° К) выше, чем у метана (112° К).
Это различие объясняется тем, что у двух молекул этана большая поверхность контакта, чем у двух молекул метана.
Тоже самое найдено для C2F6 (т. кип. 195° К) и CF4 (т. кип. 145° К); для С2Вr6 (это вещество разлагается при 483° К еще до кипения) и СВr4 (т. кип. 463° К).
Следует отметить, что на основании двух только что рассмотренных факторов (числа электронов и размера молекул) можно сделать еще один вывод:
Температура кипения возрастает пропорционально увеличению молекулярного веса.
Молекулярный вес, размер молекул и число электронов имеют тенденцию увеличиваться одновременно.
Такая взаимосвязь между молекулярным весом и температурой кипения справедлива для молекул аналогичного строения и сходных по форме.
Ван дер ваальсовы силы и форма молекул
Вещества с высокой степенью симметрии структуры обычно имеют более высокие температуры плавления, чем родственные соединения, у которых симметрия ниже.
Примеры этого можно найти среди соединений с двойной связью.
Температуры плавления и кипения цис- и транс-изомеров многих таких соединений заметно отличаются, что объясняется различиями в форме молекул.
Например, более высокая температура плавления транс-1,2-дихлорэтилена по сравнению с температурой плавления цис-1,2-дихлорэтилена может быть объяснена тем, что удлиненная и симметричная транс -форма может быть упакована в более упорядоченную и компактную кристаллическую решетку, чем «односторонняя» цис-форма.
Таблица влияние формы молекул на температуру плавления
| Соединение | Формула | Температура плавления. °С | |
| цис-изомер | транс- изомер | ||
| 1,2-Дихлорэтнлен | СlСН = СНСl | -80 | -50 |
| Бутеновая кислота | CH3CH = CHCOOH | 15 | 72 |
| Фурановая и малеиновая кислоты | НООССН = СНСООН | 130 | 290 |
Другим примером влияния молекулярной симметрии на физические свойства являются два структурных изомера формулы С5Н12.
Один из них называется нормальным пентаном, а другой — неопентаном.
Молекула «пентана имеет зигзагообразную форму. Ван дер ваальсовы силы проявляются между внешней оболочкой атомов водорода одной молекулы и такими же атомами соседних молекул.
Такая большая поверхность контакта обусловливает относительно высокую температуру кипения.
С другой стороны, такая гибкая, зигзагообразная молекула не может быть легко упакована в правильную решетку, поэтому ее кристалл имеет низкую температуру плавления.
Противоположностью является очень компактный, симметричный неопентан.
Его «шарообразная» молекула легко образует упорядоченную кристаллическую решетку, из-за своей устойчивости имеющую довольно высокую температуру плавления.
Однако расплавленный неопентан образует жидкость, которая кипит при более низкой температуре, чем температура кипения н-пентана.
Неопентан имеет меньшую поверхность контакта с соседними молекулами, чем н-пентан, поэтому он более летуч.
Следует добавить, что большинство соединений углерода конденсируется в молекулярные жидкости и твердые вещества.
Их температуры плавления в большинстве случаев низкие (ниже 300° С), причем многие соединения углерода кипят ниже 100° С.
Сходство химических свойств жидкой и твердой фаз показывает идентичность молекул в них.