Что такое окислительно восстановительные реакции
Окислительными или восстановительными свойствами обладают анионы, состоящие из одного элемента, например: S», Cl‘, Вr‘ и др.
Из схем строения, например, атома серы • +16/—2/—8/—6 и аниона серы • + 16/—2/—8/—8 и соответствующего уравнения реакции:
устанавливается, что анион серы не может принять ещё ни одного электрона.
Так как во внешнем слое у него получилась законченная оболочка из восьми электронов, в структуре анион серы уподобился инертному газу аргону.
После разбора ещё одного-двух подобных примеров делается вывод, что отрицательно заряженные ионы, состоящие из одного элемента, окислителями быть не могут, они всегда являются восстановителями.
Поэтому пишут:
Ионы-восстановители: S», Se», Сl‘, Br‘, J‘ и др.
Далее ставится вопрос: окислительными или восстановительными свойствами обладают указанные катионы, например Ag•, Mg••, Са••, Сu••, Zn•• и др.
Схема перехода электронейтральных атомов в соответствующие ионы:
Делается вывод, что рассматриваемые ионы, как имеющие во внешнем слое по восемь электронов, больше отдавать электроны не могут.
То есть не могут окисляться, они в реакциях только принимают электроны, т. е. восстанавливаются.
После разбора двух-трёх примеров восстановления положительных ионов делается запись:
Ионы-окислители: Ag•, Mg••, Са••, Сu••, Zn•• и др.
К этому обобщению следует сделать существенную оговорку, а именно:
Если какой-либо металл образует ионы различной степени окисления, то указанное правило относится только к ионам с наиболее высокой степенью окисления, а ионы с переменной и низкой степенью окисления могут быть и восстановителями.
Например, обычными ионами железа являются Fe» и Fe».
Если для иона Fe’» характерно окислительное свойство, то Fe» чаще характеризуется восстановительными свойствами.
Для иллюстрации этого положения следует разобрать пример:
где Fe« является восстановителем.
В логической связи с изложенным следует далее остановиться на окислительных свойствах веществ, содержащих атомы в различных валентных состояниях.
На примерах HNО2, HNO3, H2SO4, H2SО4 и т. п. устанавливается, что атомы многих элементов в соединениях проявляют различную положительную валентность.
Атомы с максимальной положительной валентностью могут быть только окислителями.
Делается вывод:
Анионы с промежуточной положительной валентностью могут, в зависимости от условий реакции, быть как окислителями, так и восстановителями.
Для иллюстрации этого положения можно продемонстрировать несложные опыты и написать соответствующие уравнения реакций.
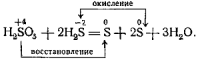
Опыт 1-й. К сероводородной воде приливается сернистая кислота.
Констатируется образование серы.
Пишется уравнение реакции:
Опыт 2-й. К йодной воде приливается сернистая кислота. Наблюдается обесцвечивание йодной воды.
Пишется уравнение реакции:
Из опытов учащиеся делают выводы, что атом четырёхвалентной серы в первом случае играет роль окислителя, а во втором — роль восстановителя.
Делается общий вывод:
Ионы окислители-восстановители:
При составлении уравнений окислительно восстановительные реакции, как уже отмечалось, прежде всего необходимо определить, какие ионы или атомы отдают или принимают электроны, что в реакции окисляется и что восстанавливается.
Статья на тему Теория окислительно восстановительных реакций


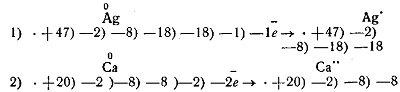

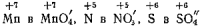
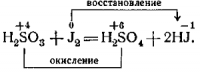
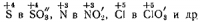
Добавить комментарий
Для отправки комментария вам необходимо авторизоваться.