Что такое окислительно восстановительный процесс электролизом
Электролиз, как известно, играет огромную роль в химической, а особенно в металлургической промышленности.
В теме для десятых классов «Основы теории электролитической диссоциации» отдельным пунктом стоит «Электролиз».
Большинство абитуриентов на вопрос, например, какие процессы происходят при электролизе хлорной меди, отвечает, что при электролизе эта соль под действием электричества разлагается на ионы; пишут, например, уравнение
СuСl2 ⇄Сu••+2Сl‘
и считают свой ответ исчерпывающим.
Перед изучением электролиза следует вспомнить учащимся принцип действия гальванических элементов.
В программе по химии гальванические элементы не отмечены, но они дважды изучаются на занятиях по физике.
Перед изучением электролиза по химии, по физике должно быть уже закончено вторичное изучение гальванических элементов.
Гальванический элемент Якоби
Без особых затруднений можно вспомнить химическую сторону действия гальванического элемента, например элемента Якоби.
Пишется на доске уравнение происходящей в указанном элементе реакции:
1) Zn + CuSO4 = ZnSO4 + Cu
в ионной форме
2) Zno + Cu•• + SO»4 =Zn•• + SO»4 + Cuo,
Демонстрируется опыт: в стакан с раствором медного купороса опускается цинковая пластинка. Пластинка скоро покрывается медью.
Устанавливается разница в реакциях в только что проделанном опыте и в гальваническом элементе Якоби.
В опыте передача электронов происходит при непосредственном контакте атомов цинка с ионами меди, а в гальваническом элементе переход электронов от цинка к ионам меди осуществляется через электрический провод.
Делается вывод, что в гальваническом элементе за счёт химической окислительно-восстановительной реакции получается электрический ток.
При этом на катоде происходит отдача электронов, окисление, а на аноде — присоединение электронов, восстановление.
Изучение электролиза целесообразно производить в два этапа.
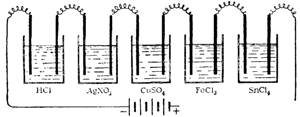
На первом этапе, в теме «Основы теории электролитической диссоциации», изучить примеры электролиза без разрядки ионов воды: электролиз хлорной меди, расплавленных солей и г. п.
На втором же этапе, например при изучении щелочных металлов, сведения по электролизу расширяются и рассматриваются примеры электролиза, в которых разряжаются и ионы воды.
При изучении электролиза на первом этапе, после демонстрации электролиза водного раствора хлорной меди, пишутся на доске уравнения реакций, происходящих на катоде и аноде:
на катоде Cu•• + 2ē = Cu0 восстановление
на аноде 2Сl‘— 2ē = 2Сl0→ Сl02 окисление
При электролизе хлористого никеля происходят следующие процессы:
на катоде Ni•• + 2ē =Ni0 восстановление
на аноде 2Сl‘ —2ē =2Сl0 → Cl02 окисление
Следовательно, электролиз есть процесс нейтрализации электрических зарядов у ионов под действием электрического тока, сопровождающийся восстановлением на катоде и окислением на аноде.
Следует подчеркнуть, что электрический ток на катоде является сильнейшим восстановителем, а на аноде — сильнейшим окислителем.
В заключение изучения электролиза на данном этапе ставится вопрос: в каком же отношении находятся процессы при работе гальванического элемента и при электролизе?
Должен быть сделан вывод, что эти процессы находятся в обратном отношении:
1) В гальваническом элементе за счёт химической окислительно-восстановительной реакции получается электрический ток.
А при электролизе электрическим током осуществляется окислительно-восстановительная реакция.
2) В гальваническом элементе на катоде происходит окисление, а на аноде — восстановление, при электролизе — наоборот: на катоде происходит восстановление, а на аноде — окисление.
Применение окислительно восстановительных процессов электролизом
1) В гальванопластике, впервые изобретённой русским академиком Б. С. Якоби (1836);
2) В гальваностегии, т. е. при покрытии металлических изделий тонким слоем другого металла;
3) При получении хлора, кислорода, водорода и т. д.
Статья на тему Окислительно восстановительный процесс электролизом

Добавить комментарий
Для отправки комментария вам необходимо авторизоваться.