Теория:
Молекулярная масса углеводорода это масса одной молекулы, выраженная в атомных единицах массы (а.е.м.).
Поэтому она рассчитывается как сумма атомных масс входящих в ее состав элементов.
Молекулярную массу любого элемента можно найти в таблице химических элементов Менделеева.
В данном случае:
Водород (Н): ≈ 1.01 а.е.м., и углерод (C) ≈ 12.01 а.е.м.
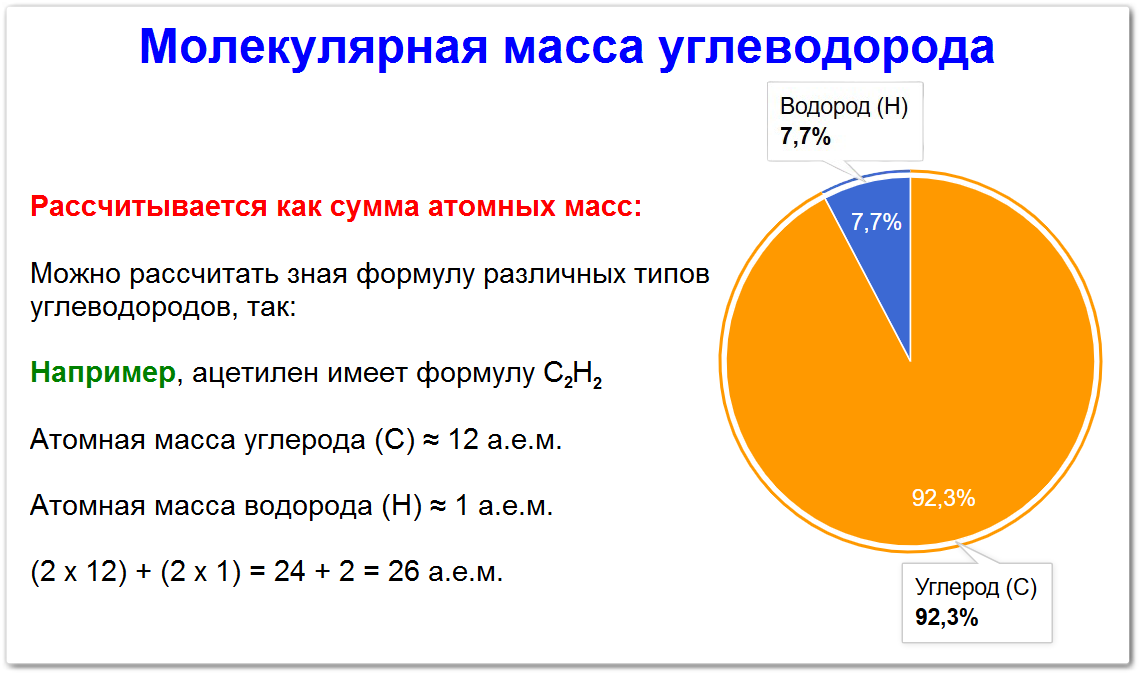
Как определить молекулярную массу углеводорода
Чтобы определить молекулярную массу конкретного углеводорода, необходимо знать его молекулярную формулу.
Для этого нужно рассчитать молекулярную массу углеводорода:
Определите молекулярную формулу (например, C2H6 для этана).
Найдите атомную массу каждого элемента:
- Углерод (C) ≈ 12.01 а.е.м.
- Водород (H) ≈ 1.01 а.е.м.
Умножьте атомную массу каждого элемента на количество его атомов в формуле.
Для этана (C2H6) : (2 × 12.01 а.е.м.) для углерода и (6 × 1.01 а.е.м.) для водорода.
Сложите полученные значения, чтобы получить молекулярную массу.
Для этана (C2H6): 24.02 а.е.м. + 6.06 а.е.м. = 30.08 а.е.м.
Таким образом, молекулярная масса углеводорода специфична для этой конкретной молекулы и зависит от количества содержащихся в ней атомов углерода и водорода.
Нельзя указать единую молекулярную массу для всех углеводородов.
От чего зависит молекулярная масса углерода
Молекулярная масса углеводорода зависит от его конкретной молекулярной формулы, которая, в свою очередь, определяется количеством атомов углерода и водорода в молекуле.
Углеводороды — это органические соединения, состоящие исключительно из атомов углерода (C) и водорода (H).
Не существует единой «молекулярной массы углеводорода«, поскольку они существуют в огромном разнообразии форм, включая:
- Алканы: Насыщенные углеводороды с общей формулой CnH2n + 2, где (n ≥ 1)
- Алкены: Ненасыщенные углеводороды, содержащие хотя бы одну двойную углерод-углеродную связь, с общей формулой CnH2n где n ≥ 2.
- Алкины: Ненасыщенные углеводороды, содержащие хотя бы одну тройную углерод-углеродную связь, с общей формулой CnH2n-2, где n ≥ 2.
- Циклоалканы: Насыщенные углеводороды, содержащие одно или несколько колец, с общей формулой CnH2n, где n≥3.
- Ароматические углеводороды (Арены): Содержат хотя бы одно ароматическое кольцо (обычно бензольное кольцо), и их формулы зависят от конкретной молекулы CnH2n–6 где n ≥ 6.
Пример решения задачи:
При сгорании 11,2 г. углеводорода получили оксид углерода массой 35,2 г и воду массой 14,4 г. относительная плотность этого углеводорода по воздуху равна 1,93. выведите молекулярную формулу.
Эту задачу можно решить в шесть стадий.
1. Определение количества вещества (молей) оксида углерода (CO₂) и воды (H₂O):
-
Молярная масса CO2 (M(CO2)) = 12 (C) + 2 х 16 (O) = 44 г/моль Количество вещества CO2 (n(CO2)) = масса CO2 / M(CO2) = 35,2 г / 44 г/моль = 0,8 моль.
-
Молярная масса H2O (M(H2O)) = 2 х 1 (H) + 16 (O) = 18 г/моль Количество вещества H2O (n(H2O)) = масса H2O / M(H2O) = 14,4 г / 18 г/моль = 0,8 моль.
2. Определение количества атомов углерода и водорода в углеводороде:
-
Каждая молекула CO2 содержит 1 атом углерода, поэтому количество атомов углерода в углеводороде равно количеству молекул CO2 (в молях): n(C) = n(CO2) = 0,8 моль.
-
Каждая молекула H2O содержит 2 атома водорода, поэтому количество атомов водорода в углеводороде равно удвоенному количеству молекул H2O (в молях): n(H) = 2 х n(H2O) = 2 х 0,8 моль = 1,6 моль.
3. Определение молярной массы углеводорода на основе его массы и количества вещества:
- Масса углеводорода (m(CxHy)) = 11,2 г
- Чтобы найти количество вещества углеводорода (n(CxHy)), нам сначала нужно определить его молярную массу. Мы можем использовать относительную плотность по воздуху.
4. Определение молярной массы углеводорода по относительной плотности по воздуху:
- Средняя молярная масса воздуха (M(воздуха)) ≈ 29 г/моль
- Относительная плотность углеводорода по воздуху (D(воздуха)) = M(CxHy) / M(воздуха)
- Молярная масса углеводорода (M(CxHy)) = D(воздуха) х M(воздуха) = 1,93 х 29 г/моль = 55,97 г/моль. Округлим до целого числа: M(CxHy) ≈ 56 г/моль.
5. Определение количества вещества углеводорода:
- n(CxHy) = m(CxHy) / M(CxHy) = 11,2 г / 56 г/моль = 0,2 моль.
- Определение индексов x и y в молекулярной формуле CxHy:
-
Соотношение количества атомов углерода к количеству вещества углеводорода: x = n(C) / n(CxHy) = 0,8 моль / 0,2 моль = 4
-
Соотношение количества атомов водорода к количеству вещества углеводорода: y = n(H) / n(CxHy) = 1,6 моль / 0,2 моль = 8
Проверка:
Молярная масса = (4 х 12) + (8 х 1) = 48 + 8 = 56 г/моль, что совпадает с молярной массой, рассчитанной по относительной плотности.
Ответ: Молекулярная формула углеводорода — C4H8 (бутен или циклобутан, но исходя из соотношения C : H, скорее всего, бутен).
Однако, учитывая, что это продукт сгорания, и мы вывели соотношение атомов, эмпирическая формула C4H8 соответствует бутену или циклобутану.
Для однозначного определения структуры потребовались бы дополнительные данные.
Часто задаваемые вопросы
Молекулярная формула углеводорода зависит от типа углеводорода.
Углеводороды — это органические соединения, которые полностью состоят из атомов водорода (H) и углерода (C).
Их можно в широком смысле разделить на насыщенные и ненасыщенные углеводороды, а также на ациклические и циклические соединения.
1. Например Алканы (насыщенные углеводороды с одинарными связями): Метан (CH4), Этан (C2H6) и Бутан (C4H10).
2. Алкены (ненасыщенные углеводороды с одной двойной связью): Этен (этилен) (C2H4), Пропен (пропилен) (C3H6) и Бутен (C4H8).
3. Алкины (ненасыщенные углеводороды с одной тройной связью): Этин (ацетилен) (C2H2), Пропин (метилацетилен) (C3H4).
А также циклоалканы, ароматические углеводороды,

Добавить комментарий
Для отправки комментария вам необходимо авторизоваться.