Коллоидные системы образованы частицами, которые не оседают под действием силы тяжести и не видимы в обычный микроскоп.
Вещество, раздробленное до частиц коллоидных размеров, имеет огромную поверхность.
Поскольку поверхностные молекулы обладают большим избытком свободной энергии, коллоиды существенно отличаются как от истинных растворов, так и от грубо дисперсных систем.
Вещество в коллоидном состоянии более реакционно способно и обладает более интенсивной окраской.
Многие практически нерастворимые в воде соединения, например сульфат бария, в коллоидном состоянии имеют заметную растворимость.
Коллоидное состояние вещества: свойства, образование, применение
Стремясь понизить избыток поверхностной энергии, коллоидные частицы слипаются в более крупные агрегаты, адсорбируют молекулы посторонних веществ или окружают себя плотной сольватной оболочкой.
Однако, непрерывно изменяясь, коллоидные системы сохраняют в то же время постоянный состав. Эта особенность очень важна для биологической эволюции материи.
В коллоидных системах, как в зародыше, заключены потенциальные возможности протекания жизненных процессов.
Коллоидное состояние — одна из наиболее распространенных форм существования вещества на Земле.
Коллоидными системами являются большинство минералов, растительные и животные организмы, вирусы.
Работами академика К. К. Гедройца с сотрудниками установлена тесная связь между коллоидно-химическими свойствами почвы и ее плодородием.
Система приобретает коллоидные свойства и в том случае, если хотя бы одно из трех измерений находится в области малой дисперсности.
Например, если небольшой кусочек твердого вещества раскатать в тонкую пленку толщиной 10-8 м или вытянуть его в тонкую нить сечением 10-8Х10-8м, то оно перейдет в коллоидное состояние.
Такими двумерными или одномерными коллоидами являются поверхностные пленки живых клеток, нервные и мышечные волокна.
Получение коллоидных систем
Поскольку коллоидные системы занимают промежуточное положение между истинными растворами и грубо дисперсными системами, для их получения возможны в два способа:
- Дробление крупных частиц вещества.
- Объединение молекул или ионов в агрегаты, соответствующие размерам коллоидных частиц.
Процессы дробления и истирания широко распространены в природе.
Дисперсные системы образуются под действием ветра, воды и перепада температур, при землетрясениях, оползнях и обвалах, при извержении вулканов и движении ледников.
В промышленности дробление веществ проводят обычно в так называемых шаровых мельницах, представляющих собой полый цилиндрический барабан, заполненный тяжелыми шарами из стали, фарфора или агата.
Измельченный материал загружают в барабан: при его медленном вращении шары перекатываются и падают, истирая и дробя вещество.
Тщательное измельчение некоторых соединений играет очень большое значение.
Например, тонко измельченные краски имеют лучшую кроющую способность и гораздо ярче; порошкообразные катализаторы более активны, а хорошо перетертые пищевые продукты приобретают дополнительные вкусовые качества.
Процессы дробления связаны с преодолением межмолекулярных сил и увеличением поверхности, поэтому они сопровождаются затратой энергии.
Достаточно сказать, что только для производства цемента в нашей стране расходуется столько электроэнергии, сколько ее вырабатывает Волжская ГЭС.
Более эффективным оказывается дробление в присутствии поверхностно-активных веществ.
На поверхности любого твердого тела имеется множество микротрещин, которые сильно понижают его прочность.
Проникая в эти микротрещины, молекулы ПАВ еще больше снижают прочность вещества, уменьшая тем самым затрачиваемые внешние усилия.
Измельчение веществ до частиц коллоидных размеров проводят в специальных коллоидных мельницах, действующих по принципу удара, трения или вибрации. Они гораздо производительнее шаровых мельниц.
Для получения жидких коллоидных растворов (золей) в настоящее время применяют ультразвуковой метод.
Под действием ультразвука (колебания с частотой 104— 105 сек-1) в жидкости происходит непрерывное образование и захлопывание полостей.
Возникающие при этом резкие локальные перепады давлений вызывают дробление жидкостей и твердых тел.
Коллоидные растворы получают также электрическим диспергированием.
Два электрода погружают концами в жидкость, сближают их и пропускают ток, достаточный для возникновения устойчивой электрической дуги.
В процессе горения этой дуги происходит отрыв мельчайших частиц металла и его испарение.
Мгновенная конденсация паров приводит к образованию коллоидного раствора.
Химические методы получения коллоидных систем
Устойчивые коллоидные растворы могут получаться в результате химических реакций гидролиза, окисления-восстановления и обмена.
Такие процессы непрерывно наблюдаются в природе.
Например, при выходе горячих глубинных вод на поверхность происходит окисление гидрокарбоната железа (II) с одновременным гидролизом Fe (III):
4Fe(HCO3)2 + O2+2H2O→4Fe(OH)3+8CO2
Образующийся коллоидный раствор гидроксида железа (III) придает природным водам буровато-красную окраску и является источником ржаво-бурых отложений («ортштейнов») в нижних слоях почвы.
Для получения коллоидного раствора гидроксида железа (III) в лабораторных условиях 10—12 мл 2-процентного раствора хлорида железа прибавляют по каплям к 100 мл кипящей дистиллированной воды.
Образовавшаяся смесь приобретает при этом ярко-красную окраску, но при охлаждении вновь бледнеет вследствие обратимости реакции гидролиза:
FeCl3 + H2O ⇄ FeCl2(OH) + HCl
FeCl2(OH) + H2O ⇄ FeCl(OH)2 + HCl
FeCl(OH)2 + H2O ⇄ Fe(OH)3 + HCl
Возникновение коллоида можно представить себе следующим образом. В пересыщенном относительно вещества А растворе появляются зародыши кристаллизации (первичные частицы).
Их возникновение зависит от множества причин: природы вещества А, вязкости среды, температуры, условий протекания химической реакции. Каждый зародыш начинает расти, захватывая вещество из окружающего пространства.
Этот рост происходит до тех пор, пока не исчезнет пересыщение.
Если скорость возникновения зародышей преобладает над скоростью их роста, то образуется коллоидный раствор: в противном случае выпадает обычный мелкокристаллический осадок.
Например, при сливании очень разбавленных растворов тиосульфата и серной кислоты получившаяся смесь остается прозрачной довольно длительное время.
Как только пересыщение достигает определенной величины, в каждом миллилитре раствора мгновенно образуется около 2 млн. зародышей, которые быстро вырастают до размеров коллоидных частиц:
3Na2S2O3 + H2SО4= 4S + 3Na2SО4 + H2О
Золи серебра, золота и платины удобно получать восстановлением их соединений в растворах. Этот метод известей очень давно.
Еще в 1857 г. М. Фарадей получил золь золота, прибавляя к водному раствору H[AuCl4] эфирный раствор белого фосфора.
За ходом коллоидообразования в данном случае удобно следить по изменению окраски.
По мере увеличения размеров коллоидных частиц окраска золя переходит от ярко-красной к синей и фиолетовой.
Метод замены растворителя
Если насыщенный раствор серы в этаноле вылить в большой объем воды, то получившаяся водно-спиртовая смесь будет по отношению к сере сильно пересыщена.
Молекулы S8 слипаются в агрегаты и образуют коллоидные частицы.
Методом замены растворителя (выливанием этанольных или ацетоновых растворов в воду) получают золи фосфора, мышьяка, канифоли и многих органических веществ.
Очистка золей
Для очистки коллоидных растворов от примеси посторонних низкомолекулярных веществ обычно используют диализ — метод, основанный на применении тонких пленок из целлофана, пергамента, коллодия и других тонкопористых материалов.
Коллоидный раствор наливают в мешочек из коллодия и помещают его в сосуд с дистиллированной водой.
Ионы и молекулы диффундируют сквозь поры пленки во внешний сосуд, а коллоидные частицы остаются в мешочке.
Дистиллированную воду в сосуде периодически заменяют.
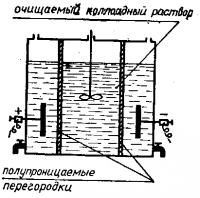
Процесс диффузии через полупроницаемую перегородку протекает очень медленно, поэтому очистка диализом длится несколько суток или даже недель.
Для ускорения процесса очистки диализ проводят под давлением. В этом случае он называется ультрафильтрацией.
На использовании этого метода основан, в частности, аппарат «искусственная почка», предназначенный для временной замены деятельности почек при некоторых заболеваниях.
Аппарат хирургическим путем подсоединяют к системе кровообращения.
В кровь под небольшим давлением, создаваемым работой сердца или пульсирующим насосом (аппарат «искусственное сердце»), протекает между полупроницаемыми мембранами, омываемыми снаружи физиологическим раствором.
Благодаря большой рабочей площади мембран ( ~ 15 тыс. см2) из крови достаточно быстро удаляются ионы калия, мочевина и другие ненужные организму продукты обмена веществ.
Быструю очистку золя от посторонних электролитов можно проводить также с помощью электролиза. Схема предназначенного для этой цели прибора (электродиализатора) показана на рисунке 2.
Под действием внешнего электрического поля ионы движутся к соответствующим электродам, а коллоидные частицы остаются в средней секции.
Устойчивость коллоидных систем
Коллоидные частицы находятся в состоянии непрерывного теплового движения. Интенсивность этого движения, называемого броуновским, увеличивается с температурой.
Броуновское движение придает коллоидным частицам кинетическую устойчивость — они не способны самопроизвольно оседать на дно сосуда или всплывать на поверхность.
Однако, поскольку вещество в коллоидном состоянии обладает большим избытком поверхностной энергии, движущиеся частицы могут при столкновении слипаться с образованием хлопьев-агрегатов, выпадающих постепенно в осадок.
Этот процесс, называемый коагуляцией, приводит к разрушению коллоидных растворов.
Поскольку, агрегатообразование представляет собой самопроизвольный процесс, коллоидные растворы являются в принципе неустойчивыми системами.
Известно, однако, что некоторые золи сохраняются в течение очень длительного времени.
Например, коллоидные растворы золота, приготовленные М. Фарадеем в середине прошлого века, до сих пор не подверглись никаким видимым изменениям.
Следовательно, они находятся в устойчивом состоянии. Главным фактором устойчивости коллоидных растворов является наличие у каждой коллоидной частицы сольватной или ионной оболочки.
В зависимости от характера межмолекулярных сил, действующих на границе раздела фаз: коллоидная частица — дисперсионная среда, коллоидные растворы разделяют на лиофильные и лиофобные.
В первых наблюдается сильное взаимодействие частиц дисперсной фазы со средой, а во вторых — слабое. В лиофильных коллоидах они окружены прочными и объемистыми сольватными оболочками, а в лиофобных коллоидах эти оболочки непрочны.
Лиофильные коллоиды более устойчивы и стоят ближе к истинным растворам. В некоторых случаях они могут образовываться самопроизвольно.
Устойчивость лиофильных коллоидов
Устойчивость лиофильных коллоидов обусловлена наличием вокруг каждой коллоидной частицы прочной сольватной оболочки, отличающейся по своим свойствам от окружающей дисперсионной среды.
Так как молекулы в сольватной оболочке определенным образом ориентированы, то она обладает более или менее правильной структурой и некоторой устойчивостью.
Коллоидные частицы могут соединиться и образовать агрегат только в том случае, если они сблизились до расстояния, на котором начинают действовать межмолекулярные силы.
Сольватные оболочки препятствуют подобному сближению, поэтому лиофильные коллоиды самопроизвольно не коагулируют.
Представим себе, что столкнулись две гидрофильные коллоидные частицы. Сольватные оболочки принимают на себя всю силу удара и начинают постепенно разрушаться.
Если энергия удара достаточно велика, то частицы сближаются до расстояния, на котором начинают действовать межмолекулярные силы, и возникает агрегат.
Если же энергия удара недостаточна для сближения частиц до требуемого расстояния, то деформированные сольватные оболочки восстанавливаются и частицы расходятся.
Чтобы разрушить лиофильный коллоид, достаточно ослабить сольватные оболочки вокруг каждой частицы. Для водных растворов это достигается добавлением большого количества электролита.
Молекулы воды переходят из сольватных оболочек частиц в сольватные оболочки ионов; устойчивость коллоида резко уменьшается и он коагулирует.
Этот процесс называется высаливанием.
Его используют в мыловарении, в целлюлозной промышленности.
Гидрофобные коллоиды можно сделать гидрофильными, если добавить к раствору какое-нибудь поверхностно-активное вещество.
Прикрепляясь своими неполярными частями к поверхности коллоидных образований, молекулы ПАВ изменяют ее характер.
В результате каждая коллоидная частица приобретает прочную гидратную оболочку. Такие «защищенные» коллоиды вдвойне устойчивы: их коагуляции препятствуют как гидратные оболочки, так и слои ПАВ.
Примером коагуляции «защищенных» коллоидов является формирование плодородной почвы в дельте Нила. Нил образуется в результате слияния двух рек: Белого и Голубого Нила.
Белый Нил берет свое начало в болотах Центральной Африки, и его воды очень богаты органическими соединениями, среди которых имеются и поверхностно-активные вещества.
Благодаря защитному действию ПАВ гидрофобные минеральные частицы приобретают прочные гидратные оболочки и удерживаются во взвешенном состоянии.
Поэтому воды Белого Нила на всем своем протяжении имеют значительную мутность.
Голубой Нил стекает с горных хребтов Эфиопии и вследствие размывания различных пород содержит большое количество растворенных солей, вызывающих коагуляцию коллоидных частиц.
Воды Голубого Нила совершенно прозрачны. После слияния двух рек Нил остается мутным, так как концентрация солей еще недостаточна для осаждения «защищенных» коллоидных частиц.
Коагуляция наступает только в устье реки — при смешивании пресной речной воды с солеными водами Средиземного моря,
Защита гидрофобных коллоидов часто встречается в природе. Так, высокое содержание в молоке малорастворимого фосфата кальция объясняется тем, что эта соль находится в виде коллоидных частиц, покрытых с поверхности белками.
Устойчивость лиофобных коллоидов
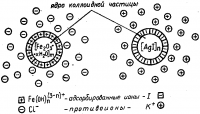
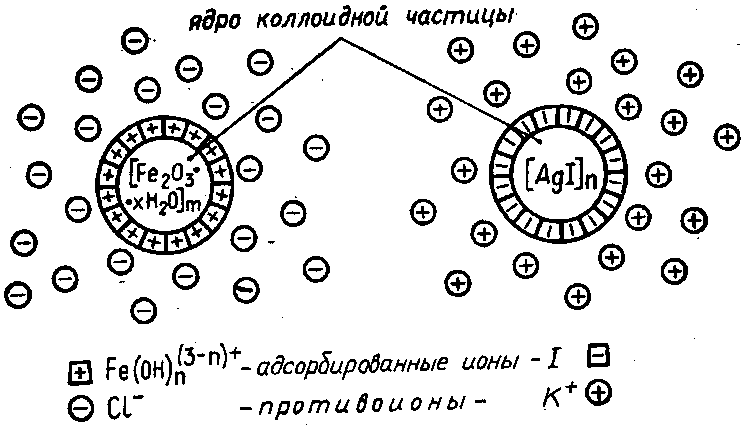
За счет адсорбции ионов из раствора коллоидные частицы всегда заряжены (рис. 3). Наличие на поверхности коллоидов одноименных электрических зарядов является главным фактором устойчивости лиофобных коллоидов.
Движущимся навстречу друг другу одинаково заряженным частицам не удается сблизиться до расстояния, на котором начинают проявляться силы межмолекулярного притяжения.
В результате гидрофобный коллоидный раствор может не изменяться даже при длительном хранении.
Полная или частичная нейтрализация поверхностного заряда сильно понижает устойчивость золей: они быстро коагулируют.
Такой нейтрализации проще всего добиться, прибавив к раствору избыток какого-нибудь электролита, например нитрата аммония.
Хотя при этом образуется равное число положительных и отрицательных ионов, но в окружающей заряженную коллоидную частицу «ионной атмосфере» всегда преобладают ионы противоположного знака; они-то преимущественно и адсорбируются частицей.
Коагуляция гидрофобных коллоидов электролитами протекает очень легко; для полного осаждения всех частиц достаточно сравнительно небольшой концентрации ионов.
Явление электрофореза
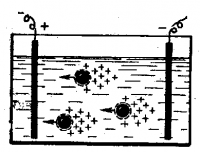
При наличии внешнего электрического поля в растворе происходит направленное перемещение положительных и отрицательных зарядов.
Коллоидные частицы вместе с плотным слоем адсорбированных ионов движутся к соответствующему электроду, а «ионная атмосфера» — в противоположную сторону (рис. 4).
Это явление называется электрофорезом.
Оно широко применяется для получения ровных и прочных керамических покрытий К и тонких пленок; разделения аминокислот, антибиотиков и ферментов; установления правильного диагноза и осуществления контроля за ходом выздоровления.
С помощью электрофореза разделяют и анализируют белки и различные компоненты плазмы крови.
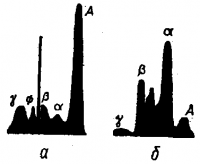
Применение сложных оптических приборов дает возможность представить процесс электрофореза в виде кривых с отдельными пиками (рис. 5).
Расстояние пика от начала отсчета позволяет идентифицировать компонент смеси, а высота пика — указывает на количество этого компонента.
Оптические свойства коллоидных систем
При прохождении света через дисперсную систему происходит его поглощение, отражение и рассеяние.
Грубо-дисперсные системы, образованные сравнительно большими по размеру частицами, в основном отражают свет; истинные растворы его поглощают, а коллоидные системы — рассеивают.
Явление светорассеяния позволяет легко отличить золи от истинных растворов и грубо дисперсных систем.
Если на стеклянном сосуде с жидкостью сфокусировать свет от сильного источника, то в случае коллоидного раствора наблюдается равномерно освещенная полоса света (конус Тиндаля).
Присутствие отдельных блесток указывает на наличие грубо дисперсной системы. Истинный раствор при наблюдении сбоку кажется совершенно прозрачным.
а — в норме; б — при нефрите (А — альбумин; Ф — фибриноген; α-, β- и γ-глобулины).
Рассеяние света коллоидными растворами было подробно изучено в 1868 г.
Тиндалем, который обнаружил, что при боковом освещении золей наблюдается характерное переливчатое свечение, и назвал его опалесценцией .
Интенсивность рассеяния света обратно пропорциональна длине волны в четвертой степени.
Следовательно, при прохождении через коллоидный раствор пучка дневного света преимущественно будут рассеиваться короткие электромагнитные волны — синяя и фиолетовая части спектра.
Именно этим объясняется синеватый цвет табачного дыма и снятого молока при боковом освещении.
Рассеянием солнечных лучей мельчайшими капельками воды и флуктуациями плотности земной атмосферы обусловлен голубой цвет неба.
Наоборот, при рассмотрении всех этих систем в проходящем свете наблюдаются красноватые оттенки, появляющиеся вследствие потери синих и фиолетовых лучей при рассеянии.
Для коллоидных растворов металлов более характерным является не рассеяние, а поглощение электромагнитных волн.
Характер поглощения зависит от размера коллоидных частиц — с увеличением дисперсности максимум поглощения сдвигается в сторону более длинных волн.
Например, золь золота, образованный частицами с диаметром около 20 нм, поглощает в основном зеленую часть спектра и окрашен в интенсивно-красный цвет. С увеличением размера частиц до 50 нм раствор приобретает синюю окраску.
Интересно, что золь золота с очень высокой степенью дисперсности имеет желтый цвет, очень сходный с окраской гидратированных ионов Аu3+.
Здесь прослеживается непрерывный переход от коллоидных растворов к истинным.
Ультрамикроскоп Электронная микроскопия
Коллоидные частицы недоступны для наблюдения в обычный оптический микроскоп.
В 1903 г. Зедентопф и Жигмонди сконструировали ультрамикроскоп — прибор, с помощью которого стало возможным наблюдать частицы размером до 3 нм, т. е. почти всю коллоидную область.
В основе работы ультрамикроскопа лежит явление светорассеяния.
В ультрамикроскоп видны не отдельные коллоидные частицы, находящиеся в непрерывном тепловом движении, а их отблески.
Подобное наблюдение не позволяет судить о размерах и форме частиц, но эти параметры могут быть определены другими методами.
Более высокой разрешающей способностью обладает электронный микроскоп, в котором на рассматриваемый объект вместо обычного света направляют пучок быстро летящих электронов.
Увеличенное изображение фотографируется или проецируется на экран.
С помощью электронного микроскопа можно непосредственно наблюдать отдельные наиболее крупные молекулы и даже атомы.
Быстрые ответы?
Относится к порядку величины молекулы, диспергированной в некоторой среде, когда эта молекула имеет диаметр примерно от 1 до 100 нм.
Коллоид это система, в которой дискретные частицы, капли или пузырьки дисперсной фазы распределены в другой фазе, обычно непрерывной.
Отличающейся от первой по составу или агрегатному состоянию и именуемой дисперсионной средой. Размеры коллоидных частиц варьируются в пределах от 0.001 до 0.1 мкм.
Высокодисперсные системы с жидкой дисперсионной средой, обладающие текучестью, называют коллоидными растворами или золями.

Добавить комментарий
Для отправки комментария вам необходимо авторизоваться.