Что такое аминокислоты состав и строение аминокислот
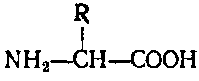
Аминокислот известно много, однако в белках встречаются лишь 25 различных аминокислот, причем у всех аминогруппа находится рядом с карбоксильной (α-аминокислоты).
Выделение аминокислот из белков и выяснение характера связи между аминокислотными остатками в белковой молекуле потребовало огромного труда и очень сложного оборудования. Полный анализ того или иного белка, включающий не только качественное определение отдельных аминокислот, но и порядок, в каком они соединены в молекуле белка, настолько труден, что завершение исследований лишь одного белка является событием в научном мире. Работы подобного рода часто выполняются совместно лабораториями нескольких стран с использованием электронносчетных машин и других современных средств исследования.
Формулы аминокислот, входящих в состав белков, можно представить, заменяя в формуле аминоуксусной кислоты (глицин) один атом водорода группы СН2 на радикалы различной природы.
В 1968 г. Международная комиссия ЮПАК рекомендовала следующие буквенные обозначения для аминокислот:
Алании А Аспарагиновая кислота D
Аргинин R Глутлмин Q
Аспарагин N Глутаминовая кислота Е
Цистеин С Пролин Р
Глицин Ge Серин S
Гистидин Н Треонин Т
Изолейцин I Триптофан W
Лейцин L Тирозин Y
Лизин К Валил U
Метионин М Неизвестные аминокислоты X
Фенилаланин F
Если неизвестно, входит ли в состав данного белка аминокислота или ее амид, то вместо N, D и Q, Е следует употреблять обозначения В* и Z*.
В большинстве руководств по биохимии для обозначения аминокислоты применяется трехбуквенный символ. Так, слово «глицин» заменяют буквами Гли, аланин — Ала и т. д. В таблице указаны названия важнейших аминокислот и соответствующая каждой формула радикала R.
Аминокислоты чаще всего делят на четыре класса в зависимости от природы замещающей группу R. К первому относят те аминокислоты, у которых R представляет собой неполярную группу, например СН3, (СН3)2СН и т. п.
Это аланин, валин, лейцин, изолейцин, фенилаланин, пролин, метионин, триптофан. Для второго класса характерно наличие полярных заместителей (Н, ОН, SH и т. п.). Они имеются в глицине, серине, треонине, цветение, тирозине, аспарагине и глутамине. Аминокислота цистеин содержит группу —SH (сульфгидрильная группа); при окислении две молекулы цистеина отщепляют по одному атому водорода от сульфгидрильной группы и образуют молекулу цистина, содержащую дисульфидную группу—S—S—. Цистин обозночают символом Цис-Цис или Цис—S—S—Цис.
К третьему классу относят аминокислоты, у которых группа R несет отрицательный заряд; это аспарагиновая и глутаминовая кислоты. Наконец аминокислоты четвертого класса имеют положительно заряженную группу R; это гистидин, лизин и аргинин.
Свойства аминокислот
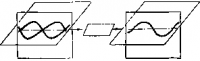
Рис. 2. Поляризация света.
Колебания электрического и магнитного поля в световой волне совершаются в различных плоскостях. После пропускания световых волн через кристалл-поляризатор остаются колебания, совершающиеся лишь в одной плоскости (поляризованный свет).
Вещества, вращающие плоскость поляризации света, называют оптически активными. В молекуле оптически активного вещества должен находиться асимметрический атом (в нашем случае это атом углерода, отмеченный звездочкой), связанный с четырьмя различными атомами или группами атомов:
Молекула глицина не содержит асимметричного атома углерода, все остальные из названных в таблице аминокислот содержат такой атом. Например, в молекуле аланина центральный атом углерода соединен с четырьмя различными группами и является асимметрическим. В этой молекуле нет ни центра симметрии, ни плоскости симметрии; две формы такой молекулы относятся друг к другу как предмет к зеркальному изображению и никакими операциями совмещены быть не могут. Они называются оптическими антиподами.
Оптическая активность природных аминокислот — характерная черта живого мира; в нем асимметрия является преобладающим признаком.
Биологические свойства антиподов неодинаковы. Так, для микроорганизмов не безразлично, содержит ли их пища право или левовращающие вещества. Один из антиподов может даже оказать токсическое действие. Сохранение организмом асимметрии и стремление его разделить рацимические смеси указывает на очень высокую ступень геометрической организации живого вещества.
Когда общий заряд молекулы аминокислоты, отщепившей протон на карбоксильном («кислом») конце и присоединившей его к аминному («основному») концу, делается равным нулю, то говорят, что молекула аминокислоты пришла в изоэлектрическое состояние. При этом образуются цвиттер-ионы. В сущности, молекула аминокислоты сама себя нейтрализовала:
Способность присоединить и отдавать протоны, конечно, не всегда одинакова, и поэтому если растворить аминокислоту в воде, не обращая внимания па значение рН, то не все молекулы ее окажутся в изоэлектрическом состоянии. Но если изменять концентрацию ионов водорода в таком растворе, т. е. изменять рН раствора, то каждую аминокислоту можно перевести в изоэлектрическое состояние. Следовательно, изоэлектрическая точка аминокислот зависит от рН и каждая аминокислота характеризуется определенным значением рН, отвечающим ее изоэлектрической точке.
Это свойство аминокислот распространяется и на белки, так как белковые молекулы состоят из полипептидных цепей, а в цепях находятся карбоксильные и аминные группы.
Заметим еще, что наличие в аминокислотах и соответственно в белках групп NH3+ и СОО~ обусловливает способность этих соединений связывать, блокировать избыточные количества ионов Н+ или ОН—, которые случайно могут возникнуть в клетках и угрожать нормальному ходу обмена веществ. Избыточные ионы водорода (т. е. фактически попы гидроксония Н3О+) взаимодействуют с карбоксил-анионом и поп водорода переходит к группе СОО— , образуя СООН; в случае избытка ОН— ионов протон от группы NH3+ отщепляется и, присоединяясь к ОН—, дает молекулу воды. В обоих случаях аминокислота или белок выравнивают случайные колебания величины рН, среда и играет роль буфера. Буферные системы крови выполняют очень ответственную работу — рН крови (и многих других жидкостей организма) не должен колебаться в пределах, превышающих единицу, без риска тяжелых нарушений.
Поэтому аминокислоты и белки являются не только строительным материалом в синтетических и структурообразующих процессах, но и сами обеспечивают сохранение среды, благоприятной для жизни.
Статья на тему Аминокислоты

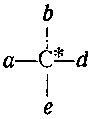
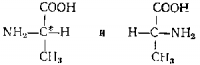
Добавить комментарий
Для отправки комментария вам необходимо авторизоваться.