Железо это химический элемент VIII группы периодической системы элементов; атомный номер 26, атомная масса 55,847.
Имеет серебристо белый цвет.
В самородном состоянии встречается только в виде метеоров или в соединении с теллуром, а также иногда встречается примеси железа с благородными металлами.
Оно обладает ярко выраженными ферромагнитными свойствами, т. е. под воздействием магнитного поля намагничивается и при прекращении действия поля сохраняет магнитные свойства, само становясь магнитом.

Химические свойства железа
Fe является весьма активным металлом. В отсутствие влаги железо на воздухе не изменяется, но при воздействии влаги и кислорода воздуха подвергается сильной коррозии и покрывается рыхлой пленкой ржавчины.
С разбавленными кислотами легко реагирует с образованием соли двухвалентного железа, превращение Fe записывают так:
Fe + 2НСl = FeCl2 + Н2↑
Но с концентрированными кислотами серная и азотная не реагирует, поэтому на это химическом свойстве металла используют при транспортировке в цистернах.
Это обосновано тем, что на поверхности железа образуется тонкая и плотная пленка окиси металла которая не вступает в другие реакции.
Реакция элемента с галогенами всегда проявляет степень окисления +3:
2Fe + 3Сl2 = 2FeCl3
Раскаленное железо вступает в реакцию с перегретым паром, превращаясь с Fe в FeO или Fe3O4(Fe2O3 · FeO):
Fe + Н2О = FeO + H2↑
На этом химическом свойстве основано получение технического водорода, но из за температурного режима и опасности взрыва практически не используется данный метод.
Физические свойства
Металл очень пластичен, легко поддается ковке, прокатке, штампованию и волочению.
Внешняя электронная оболочка атома имеет 3d⁶4s² электронов.
Наличие незаполненного 3d слоя и его относительные размеры определяют многие физические и химические свойства элемента.
Атомный вес железа 55, 84, заряд ядра +26. Распределение электронов по энергетическим уровням (+26): 2, 8, 14, 2.
Электронная конфигурация внешнего и предвнешнего слоя железа:
3s23p63d64s2.
Плотностью 7,87, температурой плавления 1535° и температурой кипения 2740°.
Его кристаллические модификации: альфа-, гамма- и дельта-железо.
До т-ры 769° С стойко альфа-железо, выше т-ры 769° С (Кюри точка) оно сохраняет кристаллическую структуру, однако теряет ферромагнетизм.
Переходя в дельта-железо; при т-ре 911° С переходит в гамма-железо, а при т-ре 1400° С гамма-железо превращается в дельта-железо.
Немагнитную модификацию железа, стойкую в интервале т-р 769—911° С, нередко наз. бета-железом.
Однако его структура тождественна высокотемпературной модификации дельта-железа и не может рассматриваться как самостоятельная.
Представитель (устаревшая классификация побочной подгруппе VIII группы).
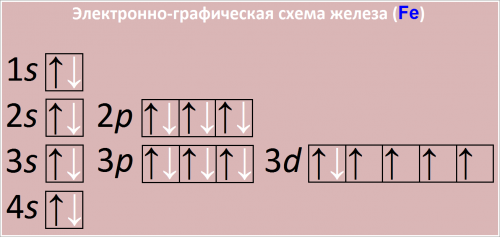
Рис. Схема распределения электронов по атомным орбиталям в атоме железа.
Изотопы
В природе металл состоит из стабильных изотопов 54Fe (5,84%), 56Fe (91,68%), 57Fe (2,17%) и 58Fe (0,31%).
Искусственно получены радиоактивные изотопы 52Fe, 53Fe, 56Fe, 59Fe и 60Fe с периодами полураспада соответственно 8,3 ч, 8,9 мин 2,9 года, 45 дней и 8,4 ч.
История открытия металла
Термин «железный век» введен в науку в середине XIX в. датским археологом К. Ю. Томсеном.
«Официальные» границы этого периода человеческой истории: от IX—VII вв. до н. э. когда у многих народов и племен Европы и Азии начала развиваться металлургия железа.
И до времени возникновения у этих племен классового общества и государства.
По источникам первые попытки получения железа уходят своими корнями в глубокую древность, а сам процесс получения железа назывался сыродутным.
Основывался на горении древесного угля, сама печь делалась в виде трубы на склоне холма или ущелья и заполнялась углем и железной рудой, в результате получалась мягкая крица.
Крица это железо с включениями шлака, а металл называли сварочным из за небольшого содержания углерода и примесей.
Крицу ковали, шлак отходил и оставался металл пронизанный шлаковыми нитями.
Но людям древности был знаком и другой вид железа дамасская сталь (или булат) делали на Востоке еще во времена Аристотеля (IV в. до н. э.).
Но технология ее производства, так же как процесс изготовления булатных клинков, много веков держалась в секрете.
И булат, и дамасская сталь по химическому составу не отличаются от обычной нелегированной стали.
Это сплавы железа с углеродом.
Но в отличие от обычной углеродистой стали булат обладает очень большой твердостью и упругостью, а также способностью давать лезвие исключительной остроты.

Добавить комментарий
Для отправки комментария вам необходимо авторизоваться.