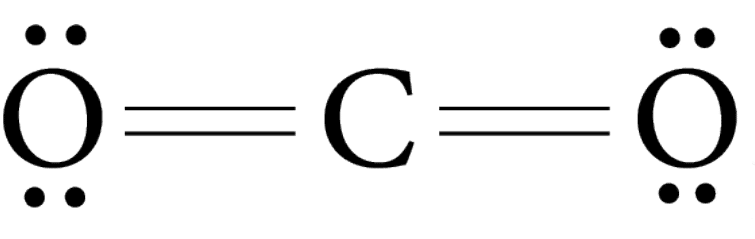Оксиды углерода это бинарные соединения углерода с кислородом, к ним относятся три химических соединения:
- Монооксид углерода или оксид углерода (II) СО.
- Диоксид углерода, или оксид углерода (IV), или углекислый газ СО2.
- И мало изученный монооксид двууглерода С2О.
Все остальные это органические вещества например:
- Диоксид триуглерода C3O2.
- Политрикарбодиоксид (C3O2)n
- 1,2,3,4-пентатетраен-1,5-дион C5O2.
- Диангидрид этилентетракарбоновой кислоты C6O68.
- Меллитовый ангидрид C12O9.
- Гексагидроксибензол трисоксалат C12O12 и так далее.
Монооксид и диоксид углерода: свойства, получение и применение
Монооксид углерода
Монооксид углерода СО или оксид углерода (II), относится к несолеобразующим оксидам.
Это бесцветный и без запаха газ, который при — 192 °С сжижается, а при — 205 °С затвердевает.
Очень ядовит и называется угарным газом. Для него характерны реакции присоединения (восстановитель):
2СО + О2 = 2СО2,
СО + Сl2 = СОСl2,
CO + FeO = Fe + CO2, СО + NaOH = HCOONa, СО + 2Н2 = СН3ОН,
СО + NH3 = HCN + Н2О.
Получение
Монооксид углерода получают:
а) в лабораторных условиях:
НСООН (Кат. H2SO4) → Н2О + СО,
Н2С2О4 (Кат. H2SO4) → Н2О + СО2 + СО;
б) в промышленности:
2С + О2 = 2СО,
С + СО2 = 2СО,
СН4 + Н2О = СО + 3Н2,
СН4 + СО2 = 2СО + 2Н2.
Применение
Применяется как топливо в составе генераторных газов и как сырье для производства многих органических веществ.
Диоксид углерода
Диоксид углерода, или оксид углерода (IV) СО2, или углекислый газ — бесцветный и без запаха газ.
Он легко сжижается и часть его в результате испарения другой части затвердевает, превращаясь в так называемый сухой лед.
За счет его испарения можно поддерживать низкотемпературный режим в бытовых условиях.
Диоксид углерода имеет свойства ангидрида и частично при высоких тем температурах — свойства окислителя:
СО2 + Н2О ⇄ Н2СО3,
СО2 + СаО = СаСО3,
СО2 + Са(ОН)2 = СаСО3 + Н2О,
СО2 + Na2SiO3 + Н2О = H2SiO3 + Na2CO3,
СО2 + СаСО3 + Н2О = Са(НСО3)2,
СО2 + С = 2СО,
CO2 + 2Mg = 2MgO + C.
Получение
Диоксид углерода получают:
а) в лабораторных условиях:
СаСО3 + 2НСІ = СаСl2 + Н2О + СО2;
б) в промышленности:
СаСО3 = СаО + СО2.
Диоксид углерода образовывается также при сжигании всех органических веществ:
2С8Н18 + 25О2 = 16СО2 + 18Н2О,
С6Н12Об + 6О2 = 6СО2 + 6Н2О,
СН3СОСН3 + 4О2 = ЗСО2 + ЗН2О,
C2H5OH + ЗО2 = 2СО2 + ЗН2О.
Применение
Углекислый газ применяется для производства соды, синтеза органических кислот, изготовления шипучих напитков, а также участвует в фотосинтезе:
NaCI + СО2 + NH3 + Н2О = NaHCO3 + NH4CI,
СО2 + Н2О ⇄ Н2СО3,
6nСО2 + 5nН2О = (С6Н10О5)n + nО2.
Быстрые ответы?
Наиболее известные оксиды углерода:
1. Монооксид углерода CO (угарный газ).
2. Диоксид углерода CO2 (углекислый газ).
3. Малоизученный монооксид двууглерода С2О.
А также к ним относятся органические вещества например 1,2-диоксетандион C2O4, гексагидроксибензола трис-карбонат C9O9 и другие.
Оксид углерода (IV) СО2 — типичный кислотный оксид. Он может взаимодействовать с водой образуя угольную кислоту Н2СО3, основными оксидами и щелочами.
Угарный газ CO имеет несколько меньшую плотность, чем воздух. Его химическая формула — CO, что означает, что это молекула, состоящая из одного атома углерода и одного атома кислорода.
Он отличается от углекислого газа (CO2), который имеет один атом углерода и два атома кислорода.