ТАЛЛИЙ анализ TI, Качественная реакция на Таллий
Метиловый фиолетовый (МФ)
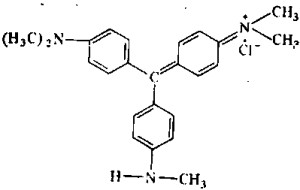
Метилвиолет C24H28N3Cl, ММ 393,45
Зеленый с металлическим блеском порошок (кусочки) — смесь тетра-, пента-, гексаметилзамещенных парарозанилинов; растворим в воде, глицерине, эт. В спектре водного раствора имеются полосы поглощения для мономера с λmах= 586÷590 нм, димера λmах =542÷544 нм; константа димеризации КДИМ= 4,4·102. Растворы МФ восстанавливаются сульфитом.
Применяют в качестве кислотно-основного индикатора [67], для ЭФО таллия [55, 109], концентрирования микронримесей при анализе
сталей [272, с. 58—66], железо-марганцевых конкреций [617, с. 36—93].
ЭФО таллия. Анион TlCl4— в 0,15—0,8 М НСl с МФ образует экстрагируемый толуолом, бзл. ИА. В спектре толуолыюго раствора ИА есть полоса с поглощением в λmах= 570 нм, E=50·103.
Мешают —H3BO3, Au (III), Hg (II) (отделяют цементацией на меди).
Выполнение ЭФО. После отделения таллия от ртути, золота, сурьмы цементацией на меди анализируемый раствор с содержанием до 30 мкг таллия в объеме ~30 мл и 3,2 М по Н3РO4 вносят 1 мл 20%-ного FeCl3, 8 капель пергидроля. Спустя 40 мин переливают в делительную воронку, приливают 20 мл толуола, 1 мл 0,2%-ного раствора МФ. Взбалтывают 1 мин. После разделения фаз измеряют ОП органической фазы при 570 нм.
Тиомочевина
Тиомочевина с Tl (I) в кислых растворах образует КС-катион, который с анионами ClO4—, NO3— дает малорастворнмые ИА. Мешают —Pb, Cd, Сu (I).
Применяют для отделения, концентрирования таллия [226, 288], АмпТТ таллия [594].
Тетрафенилборат натрия
Таллий (1) с тетрафенилборатом натрия образует малорастворимый ИА, применяемый для ГО таллия [288].
Таллий анализ

Добавить комментарий
Для отправки комментария вам необходимо авторизоваться.